藥品抽檢是上市后監管的重要手段,在打擊違法違規、評價藥品質量狀況、保障公眾用藥安全等方面發揮著重要作用。2020年,國家藥監局堅持以“四個最嚴”為根本指南,組織各省級藥品管理部門與相關檢驗機構,在全國范圍內對部分藥品質量開展抽查檢驗工作,并深化成果應用,不斷加強抽檢管理與頂層設計,完善制度體系、整合資源形成監管合力,服務監管的效能進一步顯現。2020年抽檢結果顯示,我國當前藥品質量仍處于較高水平,安全形勢總體平穩可控。
一、概述
為貫徹落實《中華人民共和國藥品管理法》和《中華人民共和國疫苗管理法》,2020年,國家藥監局根據《藥品質量抽查檢驗管理辦法》等有關要求,以品種為主線,堅持問題導向和風險控制原則,密切結合監管需要,制定年度抽檢計劃和實施方案。國家藥品抽檢采取“分散抽樣、集中檢驗、探索研究、綜合評價”的工作模式,按照國家藥監局的統一部署,各省級藥品監管部門負責組織各行政區域內的樣品抽取,并將同一品種的全部樣品交由同一藥品檢驗機構集中檢驗;檢驗機構確認收到樣品后,采用“非現場結算”方式統一支付購樣費用,并將檢驗結果以“電子檢驗報告書”的形式在線傳遞至有關省級藥品監管部門。在法定標準檢驗的基礎上,各檢驗機構緊盯突出問題、結合監管需求開展有針對性的探索性研究,對抽檢品種進行“綜合體檢”,及時發現、防控風險隱患,督促企業落實質量安全主體責任。
2020年國家藥品抽檢共完成136個品種18013批次制劑產品與中藥飲片的抽檢任務,樣品來源涉及3586家藥品生產、經營企業和使用單位,覆蓋境內31個省區市和新疆生產建設兵團,由47家藥品檢驗機構承擔檢驗和探索性研究任務。對檢出的104批次不符合規定產品,國家藥監局均依照“風險控制-依法處置-排查原因并整改-信息公開”的監管模式,確保風險關閉、警示用藥安全。一方面,迅速組織各級藥品監管部門及時監督相關企業或單位采取召回、暫停生產銷售等有效風險控制措施,對涉事企業或單位依法進行調查處理,深入排查原因、徹底消除隱患;另一方面,以通告的形式,依法及時向公眾發布不符合規定產品信息,筑牢公眾用藥安全防線,全年共發布藥品質量通告6期。針對探索性研究發現的問題線索,國家藥監局綜合研判,依照風險等級及時采取控制措施,對個別涉嫌違法違規生產的企業,組織開展針對性檢查;對其他一般性問題,采取風險提示等措施督促相關企業排查整改。
二、抽檢數據分析
(一)抽樣情況
2020年國家藥品抽檢共抽取制劑產品與中藥飲片品種136個,包括化學藥品77個、中成藥48個、中藥飲片8個和生物制品3個,其中國家基本藥物品種45個;共抽檢樣品18013批次,包括生產環節4106批次、經營環節13143批次和使用環節764批次(見圖1),涉及1053家藥品生產企業、2186家藥品經營企業和347家藥品使用單位,各省(區、市)樣品抽取情況以及所抽取樣品的標示生產企業所在地區抽樣分布情況,分別見圖2與圖3。
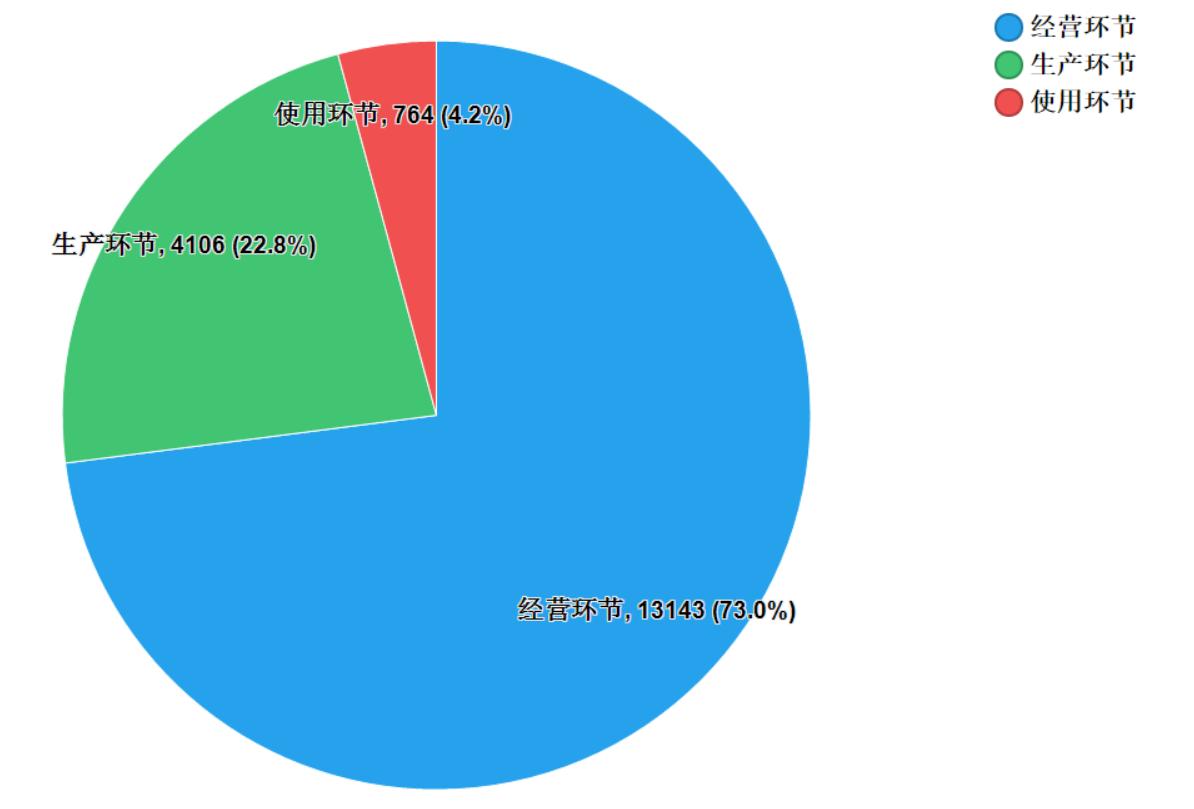
圖1. 生產、經營、使用環節抽樣情況
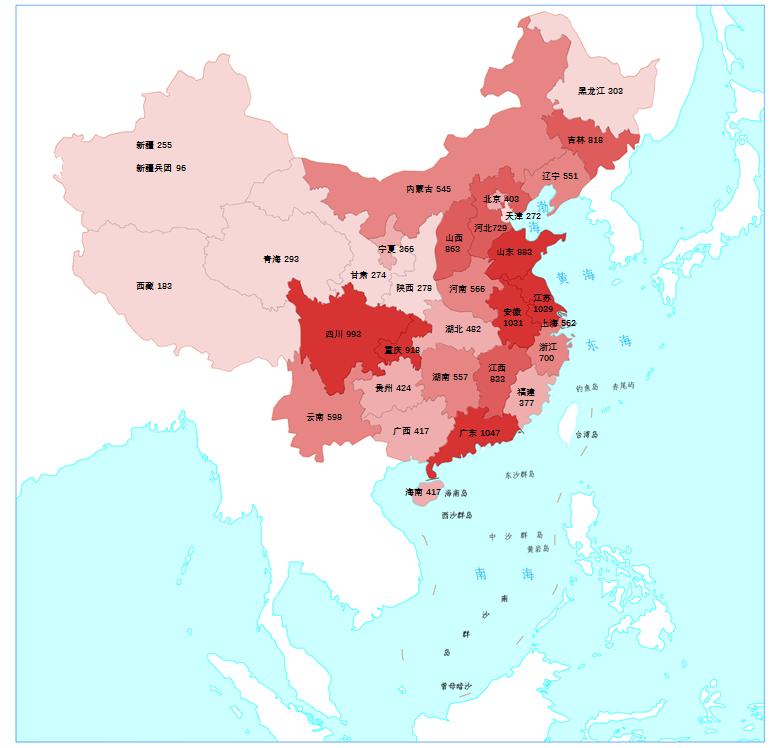
圖2. 抽檢樣品來源分布圖
(注:圖中數字為各省抽樣批次數,顏色由淺到深分別表示抽樣批次數由低到高)
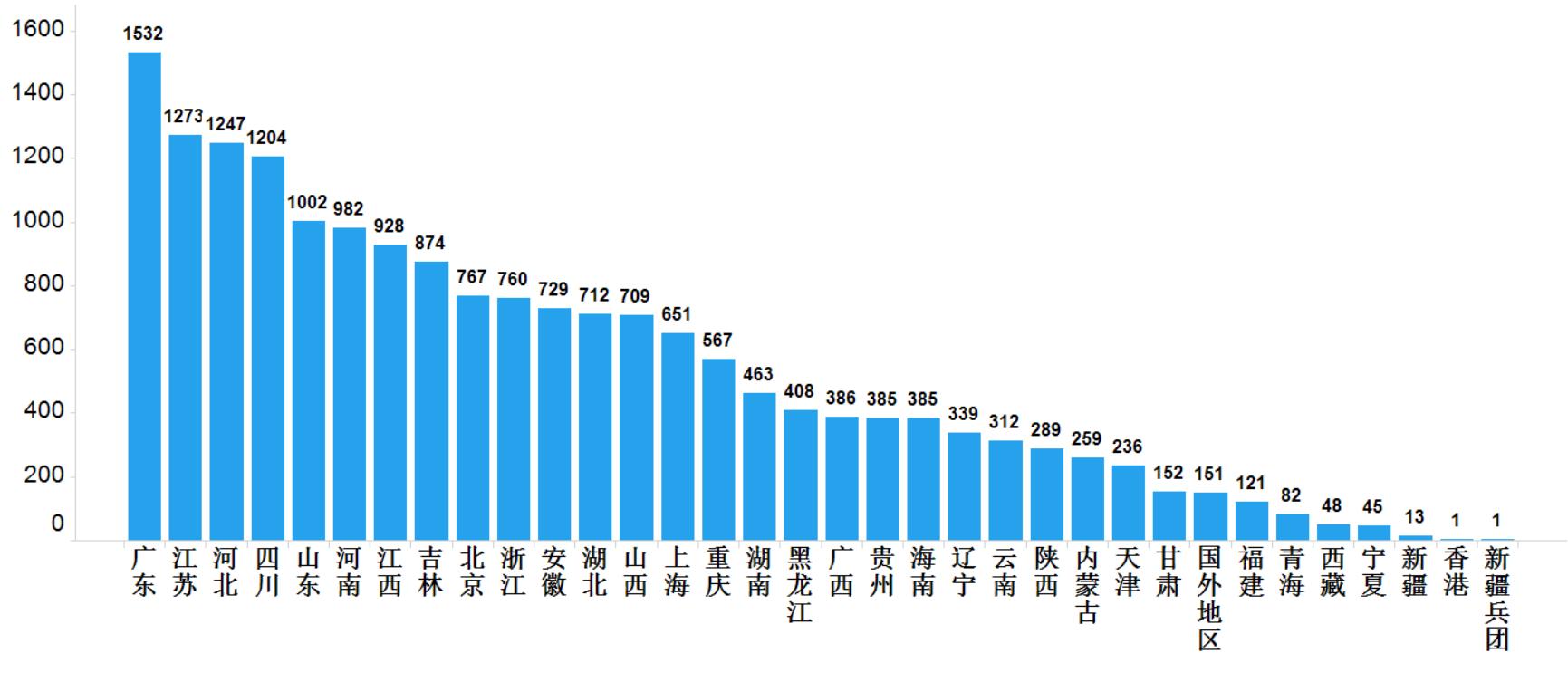
圖3.抽檢樣品產地分布圖
(二)藥品制劑抽檢數據分析
2020年國家藥品抽檢共抽檢制劑產品16645批次。經檢驗,16568批次產品符合規定,77批次產品不符合規定,其中有2批次樣品按照補充檢驗方法檢驗檢出金胺O。抽檢的128個品種中,全部樣品符合規定的制劑產品有106個,共13179批次。其中,化學藥品有64個品種8046批次,中成藥有39個品種5043批次,生物制品有3個品種90批次。
1. 化學藥品
2020年國家藥品抽檢共抽檢化學藥品77個品種10217批次,涉及生產環節2370批次、經營環節7322批次和使用環節525批次。經檢驗,不符合規定43批次,在生產、經營和使用環節檢出不符合規定產品15、27和1批次,分別占對應環節全部樣品的0.6%、0.4%和0.2%(見圖4)。
2020年國家藥品抽檢共涉及18個劑型,共有8個劑型存在不符合規定產品。其中,注射用無菌粉末(28批次)、片劑(7批次)、膠囊劑(2批次)、腸溶片劑(2批次)、顆粒劑(1批次)、注射劑(1批次)、口服溶液劑(1批次)、緩釋片劑(1批次),分別占對應劑型全部產品的1.5%、0.3%、0.2%、0.9%、0.2%、0.1%、0.4%和1.6%(見圖5)。
不符合規定項目包括性狀、檢查和含量測定,不符合規定產品數量依次為1、42和1批次,分別占全部不符合規定項目的2.3%、95.4%和2.3%(見圖6)。
抽檢數據顯示,生產環節與經營環節出現不符合規定情況高于使用環節,且注射用無菌粉末在上述兩個環節占比較大,分別檢出不符合規定產品13批次與15批次,占對應環節不符合規定樣品的86.7%和55.6%;不符合規定項目均為檢查項,涉及“溶液的澄清度與顏色”“可見異物”“有關物質”等檢驗項目,不符合規定原因主要與生產工藝不穩定、包裝材料質量控制不嚴、貯藏條件選取不當存在關聯。提示生產企業應嚴格包裝材料入廠檢驗,優化生產工藝管理與關鍵質量參數控制,重點關注分裝與滅菌工藝的穩定性;經營企業應完善藥品儲存、運輸過程管理,提升溫濕度控制水平,重點關注需遮光、冷藏貯存的藥品。
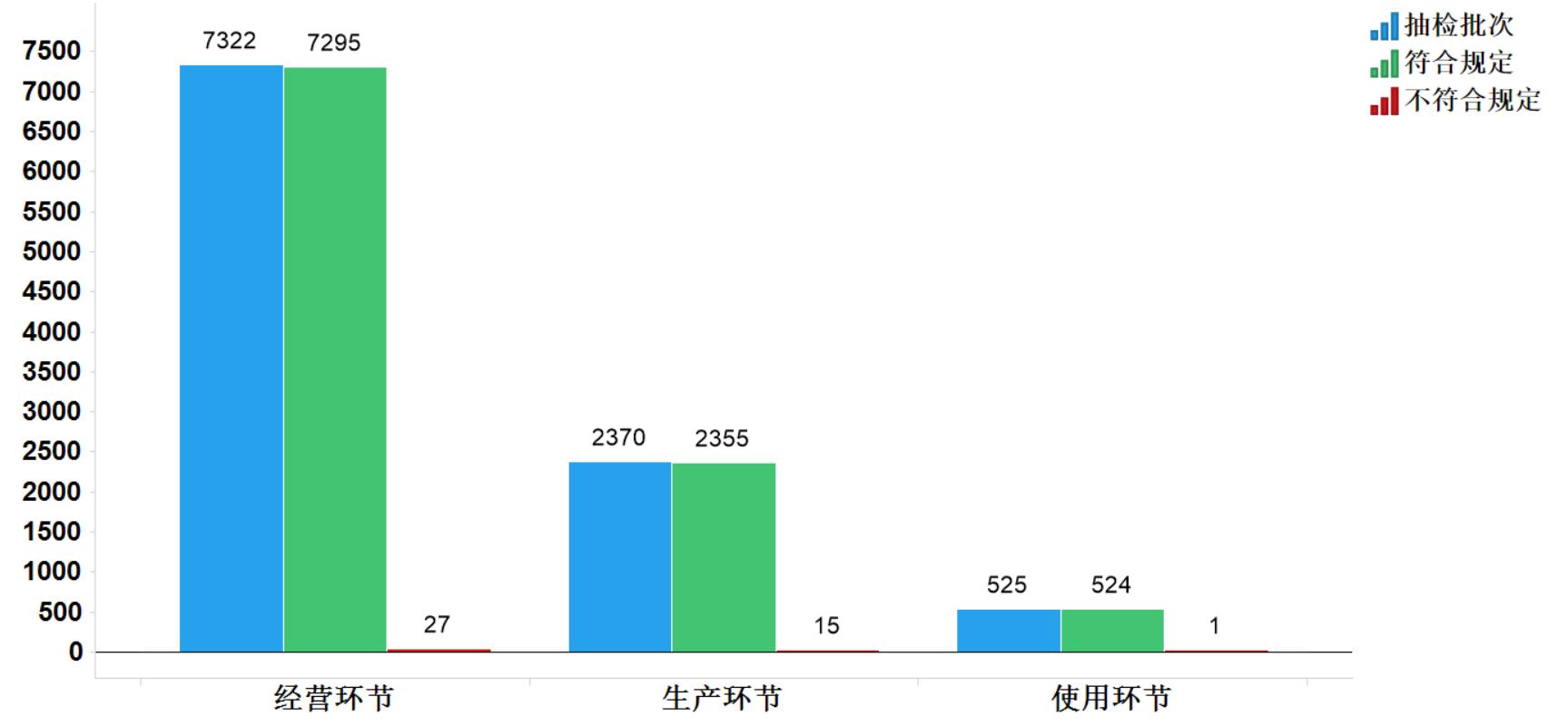
圖4.化學藥品各抽樣環節檢驗信息示意圖
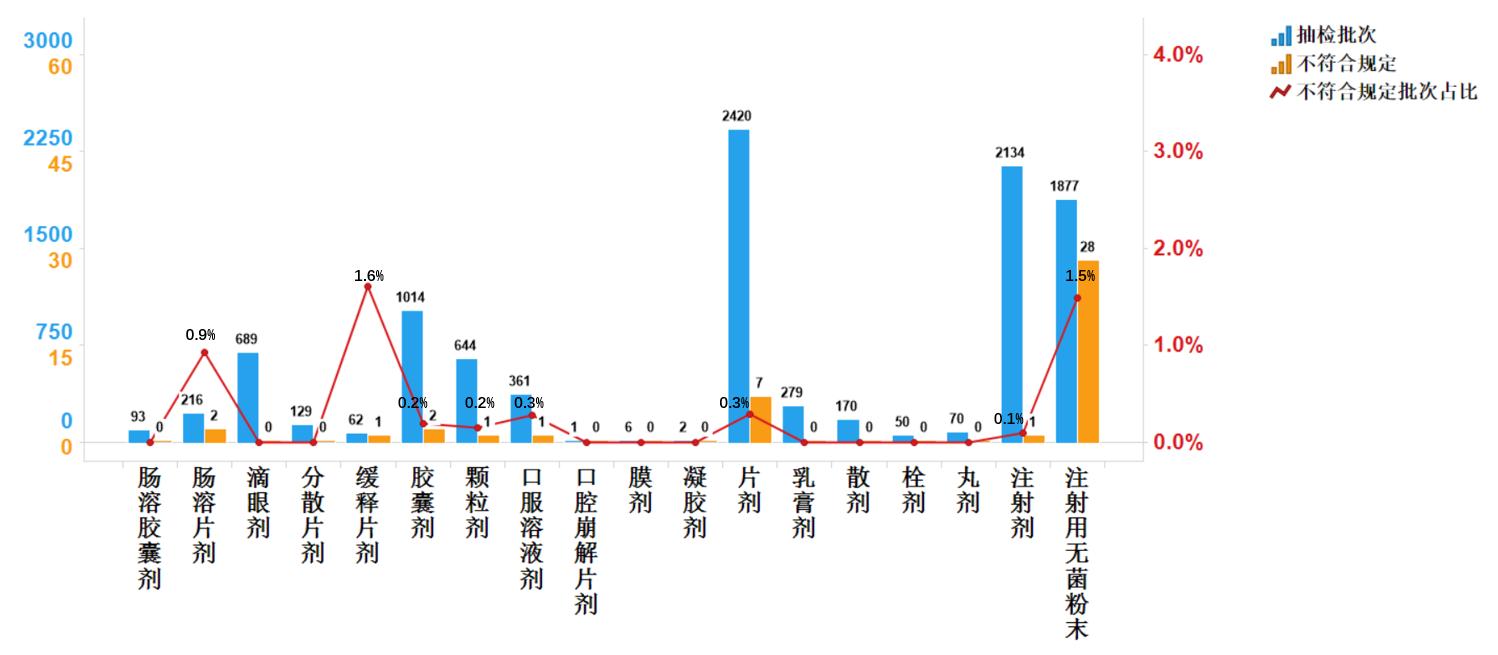
圖5.化學藥品各劑型檢驗信息示意圖
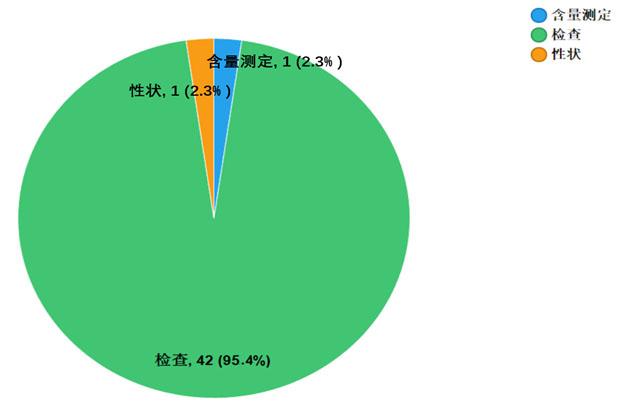
圖6.化學藥品不符合規定項目分布圖
(注:某些不符合規定產品涉及多個不符合規定項目)
2. 中成藥
2020年國家藥品抽檢共抽檢中成藥48個品種6338批次,涉及12個劑型,在生產、經營和使用環節各抽取樣品1072、5197、69批次。經檢驗,符合規定6304批次,不符合規定34批次(含2批次產品經補充檢驗方法判定不符合規定),分別在生產與經營環節檢出不符合規定產品1和33批次,分別占對應環節全部樣品的0.1%和0.6%(見圖7)。
不符合規定項目主要涉及檢查、性狀、鑒別、含量測定等,不符合規定產品數量依次為14、2、15和2批次,分別占全部不符合規定項目的40.0%、5.7%、42.9%和5.7%(見圖8)。
不符合規定產品主要涉及5個劑型,其中丸劑(16批次)、顆粒劑(7批次)、片劑(5批次)、散劑(5批次)和注射劑(1批次),分別占對應劑型全部樣品的2.0%、0.5%、0.4%、2.7%、0.1%(見圖9)。
抽檢數據顯示,丸劑與散劑不符合規定批次占比較高,不符合規定項目包括鑒別與檢查,不符合規定原因主要與藥材摻偽、制劑工藝控制不嚴等存在關聯,提示有關企業應加強人員培訓,規范生產管理,嚴格工藝規程與購進藥材質量控制。
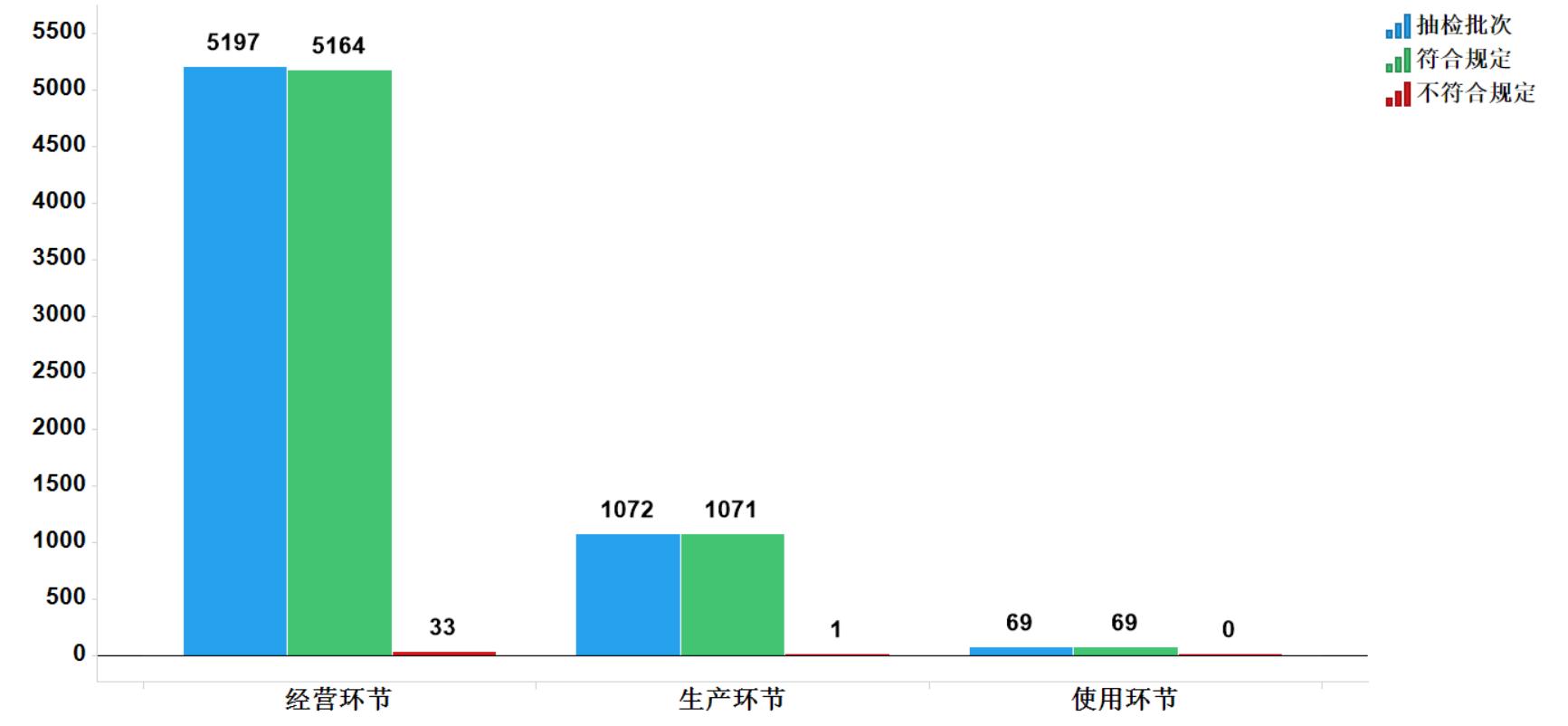
圖7.中成藥各抽樣環節檢驗信息示意圖
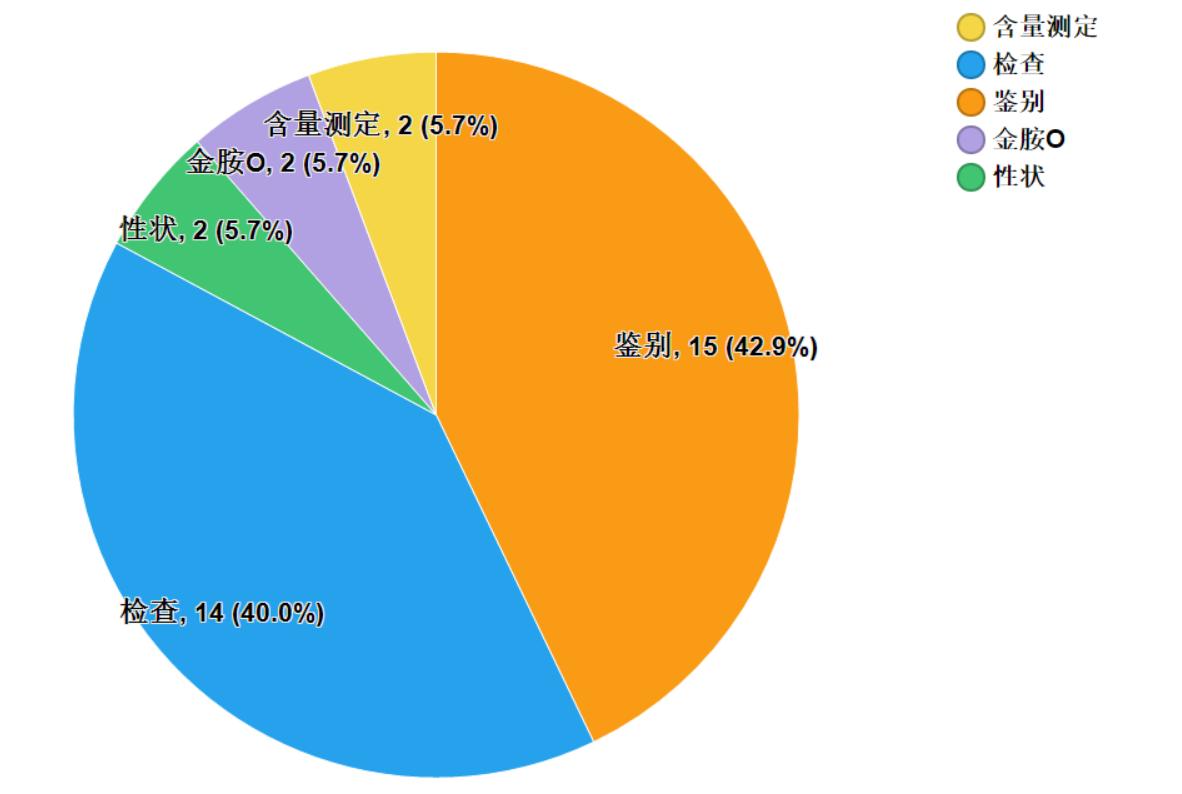
圖8.中成藥不符合規定項目分布圖
(注:某些不符合規定產品涉及多個不符合規定項目)
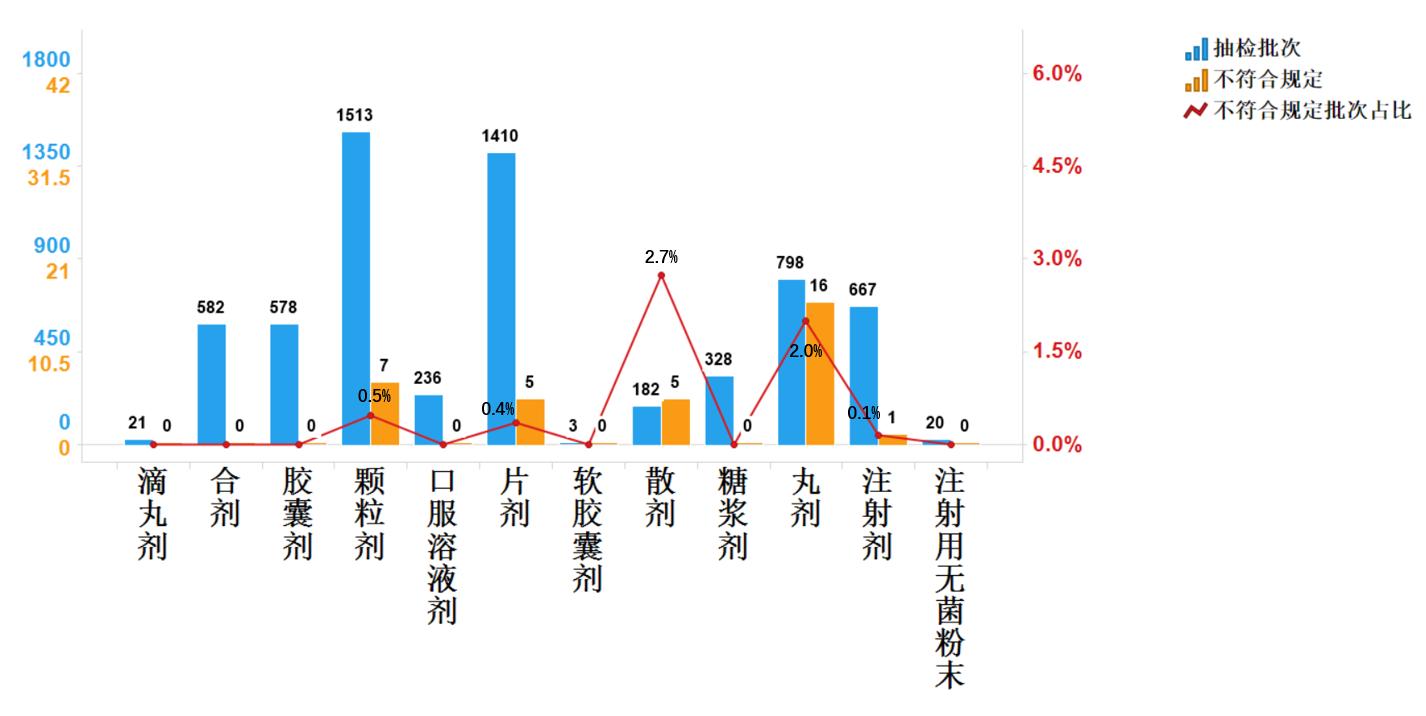
圖9.中成藥各劑型檢驗信息示意圖
3. 生物制品
2020年國家藥品抽檢共抽檢生物制品3個品種90批次,其中治療類品種1個,預防類品種2個(見圖10)。樣品均抽自生產環節,劑型均為注射劑。經檢驗,所檢項目均符合規定,合格率為100%。
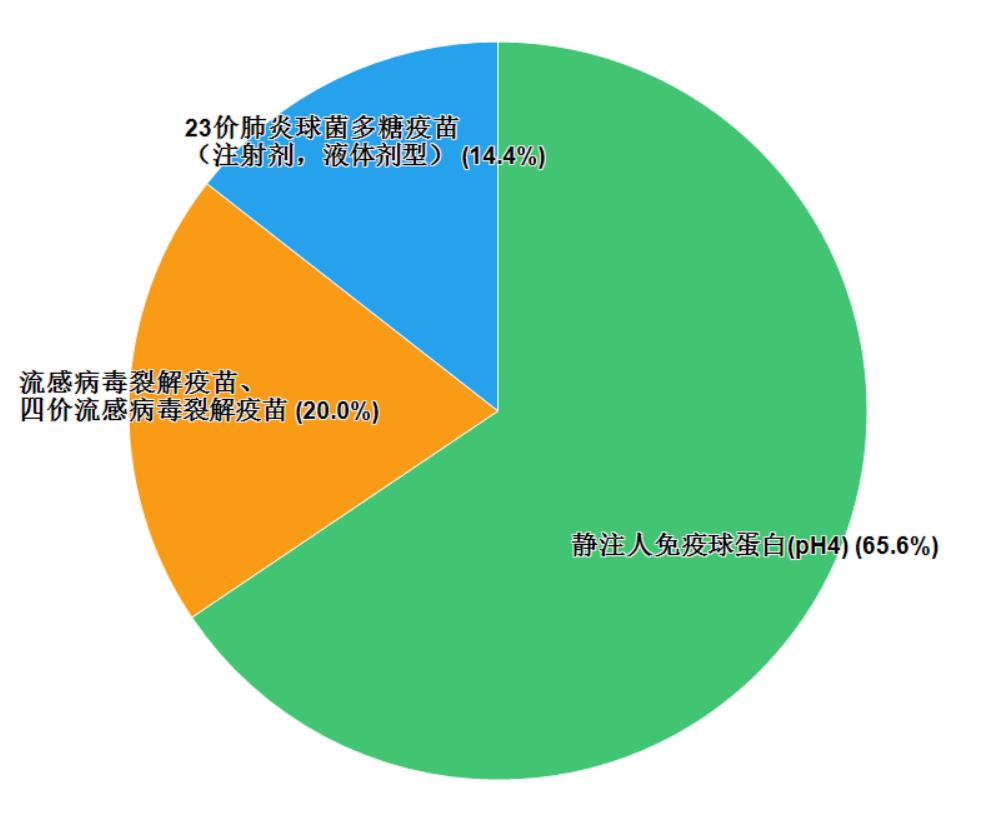
圖10.生物制品抽檢品種信息示意圖
4. 國家基本藥物
2020年國家藥品抽檢共抽檢基本藥物(不含中藥飲片)37個品種6167批次,在生產、經營和使用環節各抽取樣品1260、4625和282批次。經檢驗,不符合規定25批次,分別在生產與經營環節檢出不符合規定產品8和17批次,涉及4個劑型。
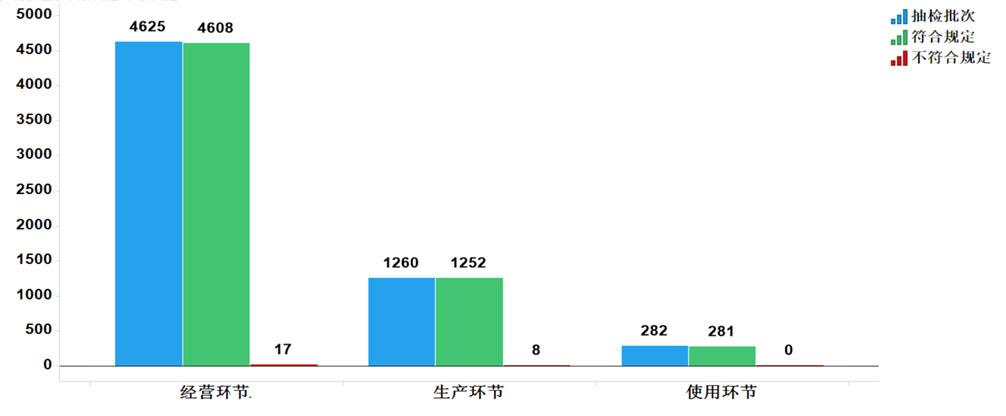
圖11.國家基本藥物各抽樣環節檢驗信息示意圖
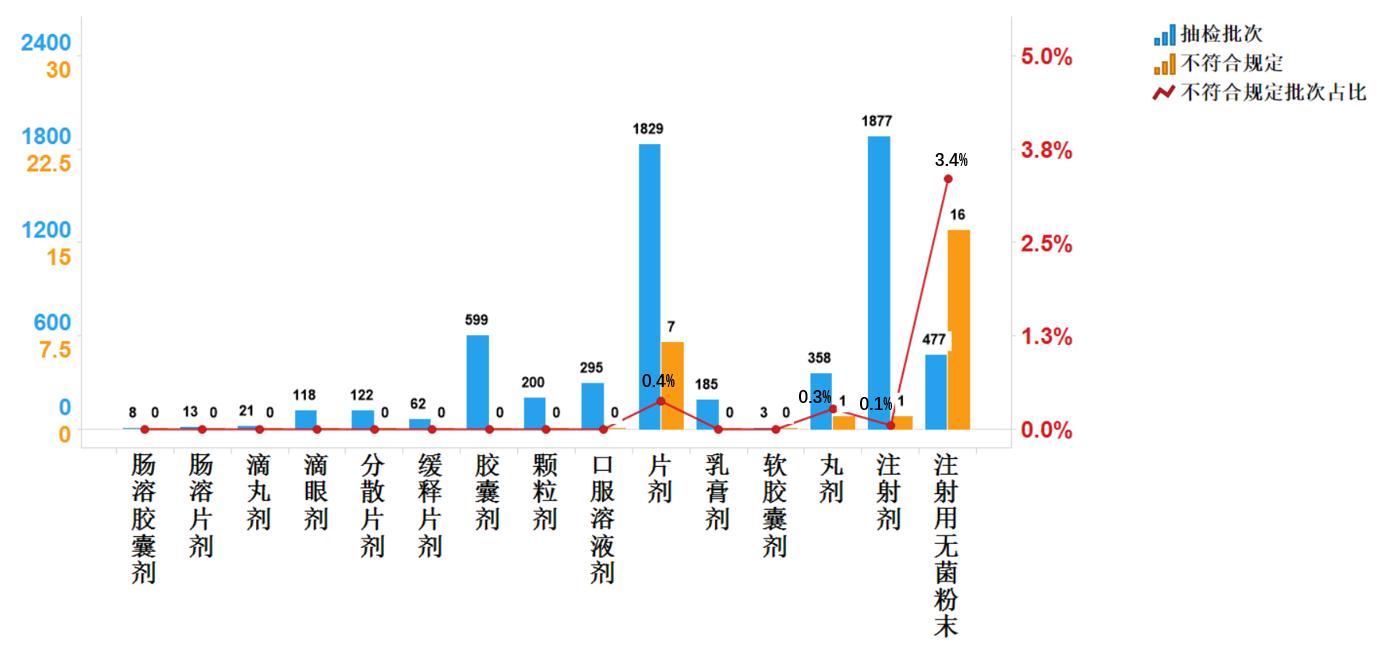
圖12. 國家基本藥物各劑型檢驗信息示意圖
5. 抗病毒中成藥專項
2020年國家藥品抽檢設置了抗病毒中成藥專項,以有效識別風險、保障臨床常用關鍵抗病毒中成藥的質量。
2020年共抽檢抗病毒中成藥932批次,涉及5個劑型(圖13)。經檢驗,符合規定930批次,合格率99.8%。在生產、經營和使用環節各抽取樣品137、790和5批次,分別在生產與經營環節檢出不符合規定產品1批次(圖14)。
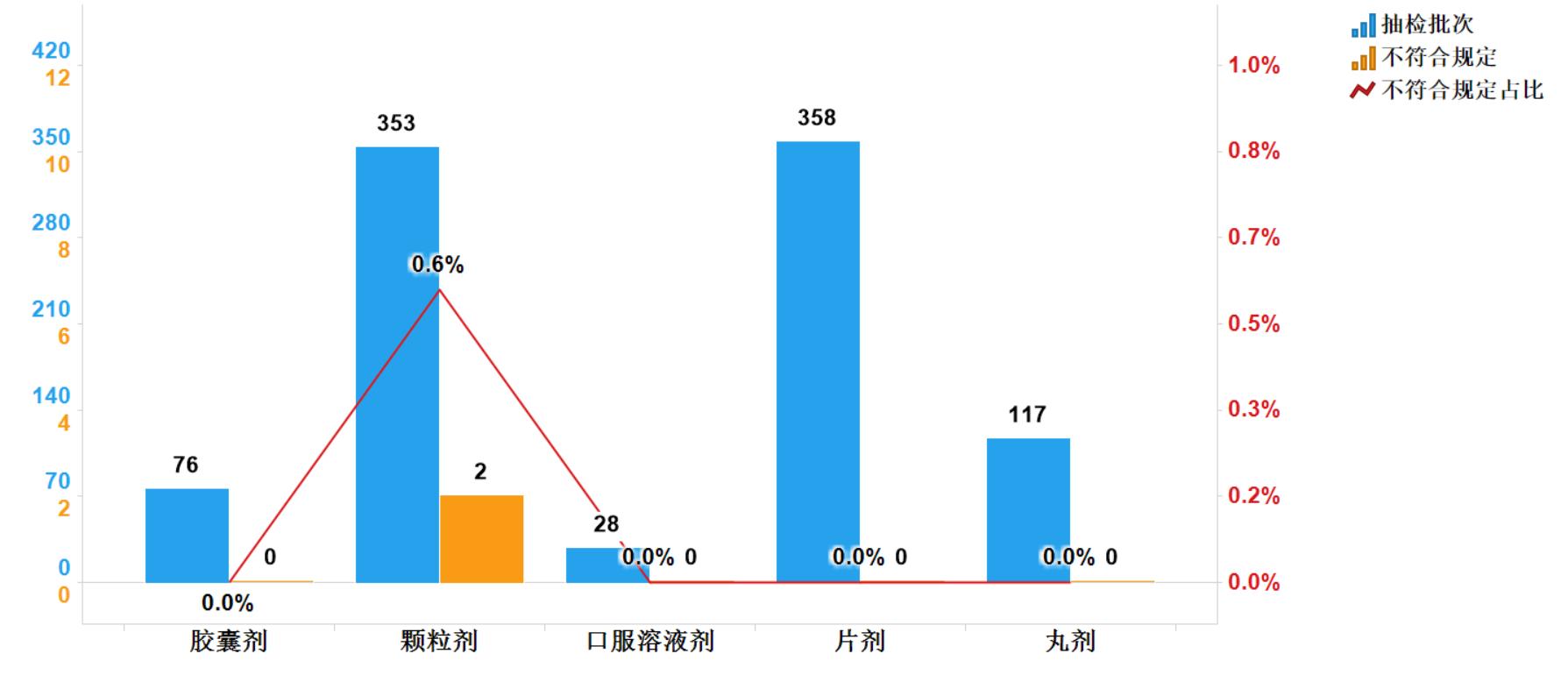
圖13. 抗病毒中成藥專項各劑型檢驗信息示意圖
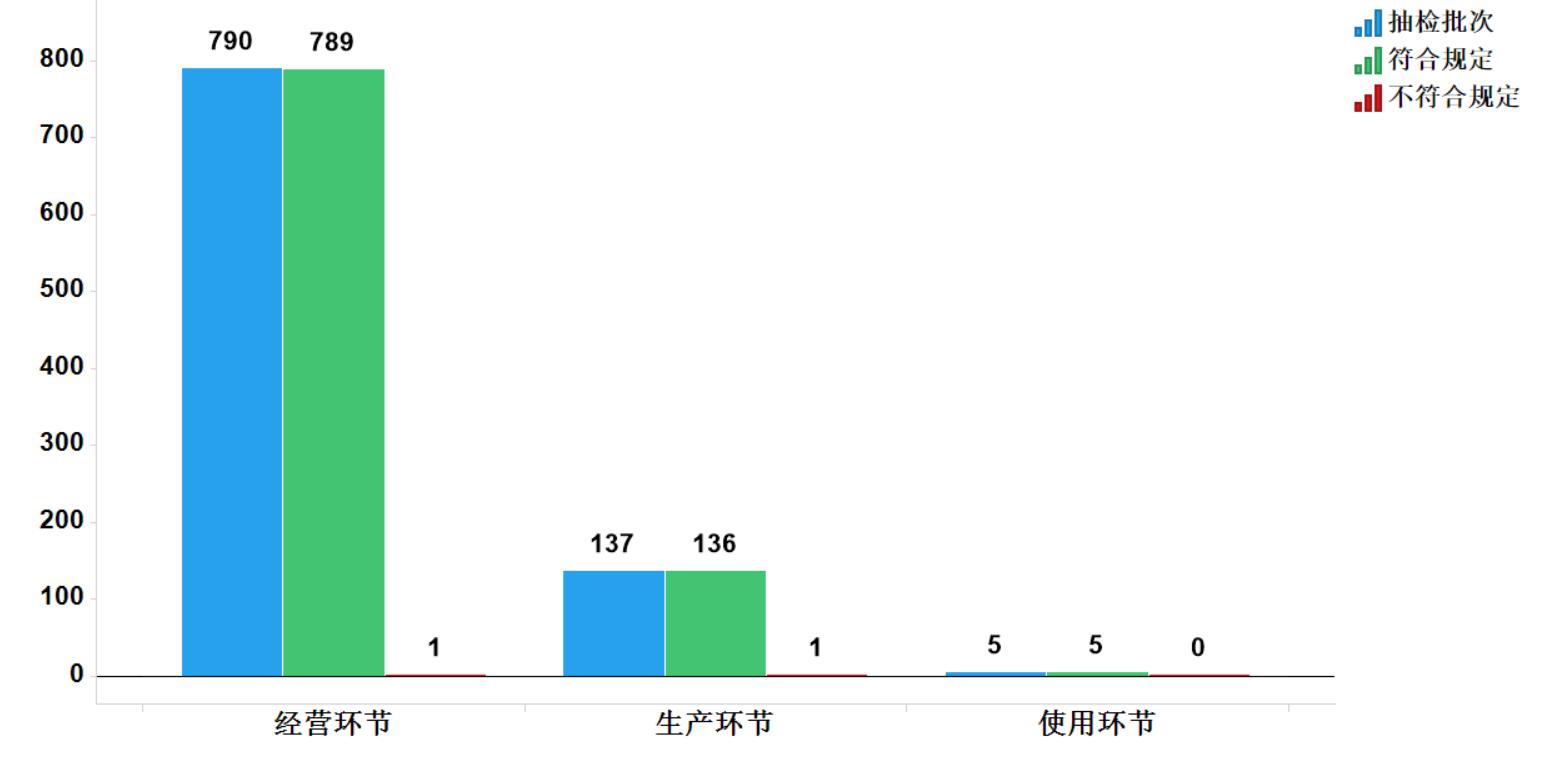
圖14. 抗病毒中成藥專項各抽樣環節檢驗信息示意圖
(三)中藥飲片專項抽檢情況
2020年,國家藥監局組織開展了中藥飲片專項抽檢。主要針對近年來銷量增大的中藥飲片中較為突出的摻偽摻雜等問題,以及種植/養殖、加工炮制等不規范而造成的質量問題,開展檢驗和探索性研究。
2020年國家藥品抽檢共抽檢8個中藥飲片品種1368批次。經檢驗,符合規定1341批次,不符合規定27批次(見圖15)。不符合規定項目主要涉及總灰分(2批次)、性狀(23批次)、雜質(2批次)、鑒別(4批次)和含量測定(1批次)等方面,分別占全部不符合規定項目的6.3%、71.9%、6.3%、12.5%和3.0%(見圖16)。
2020年國家藥品抽檢發現的主要問題有:一是摻偽、正偽品混用問題,如制川烏中混入部分附子;二是有害殘留物質超限問題,如部分批次前胡農藥殘留超限;三是采收與加工炮制不規范,如廣藿香未按標準方法采收,部分批次黃精加工炮制不規范造成總灰分超標。抽檢結果提示,有關企業應規范采收加工及炮制工藝,加強進廠或投料前檢驗,嚴格儲運條件,控制環境濕度,提高質量意識。
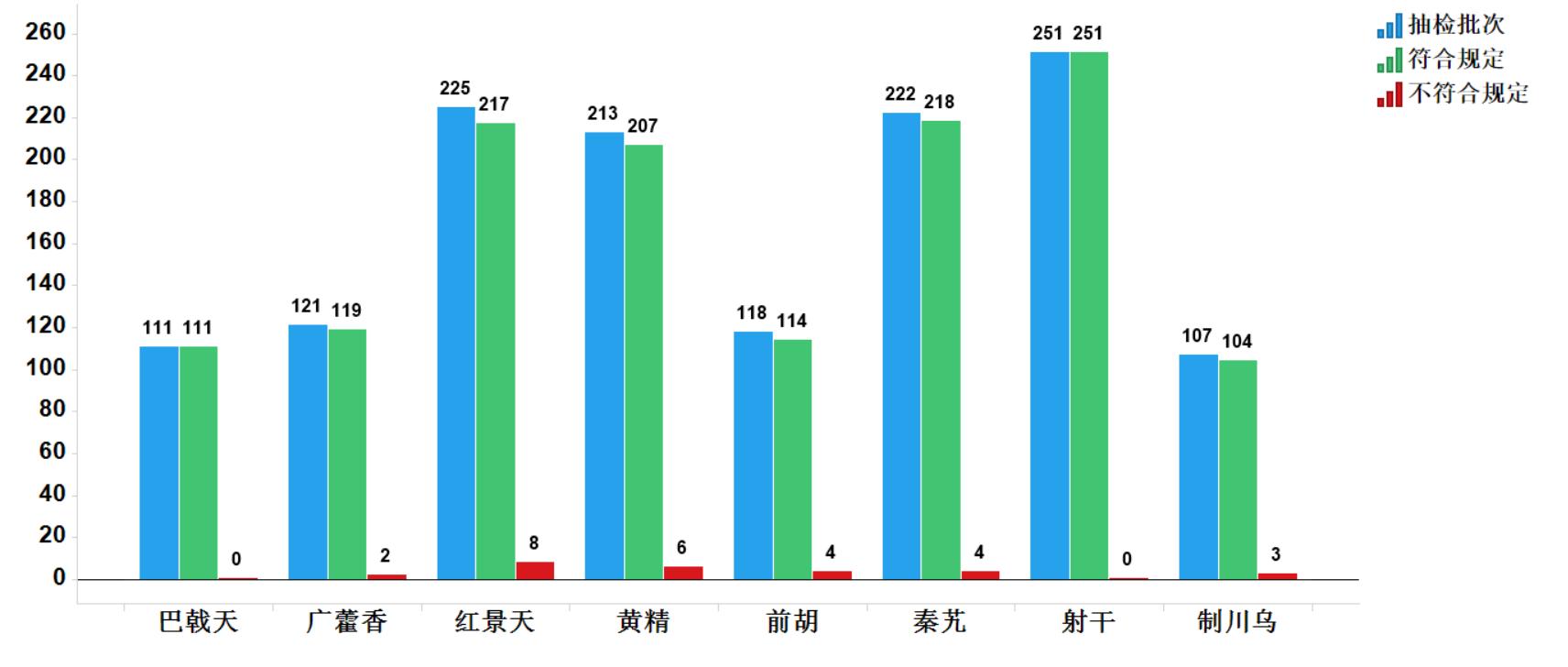
圖15. 2020年中藥飲片專項抽檢結果示意圖
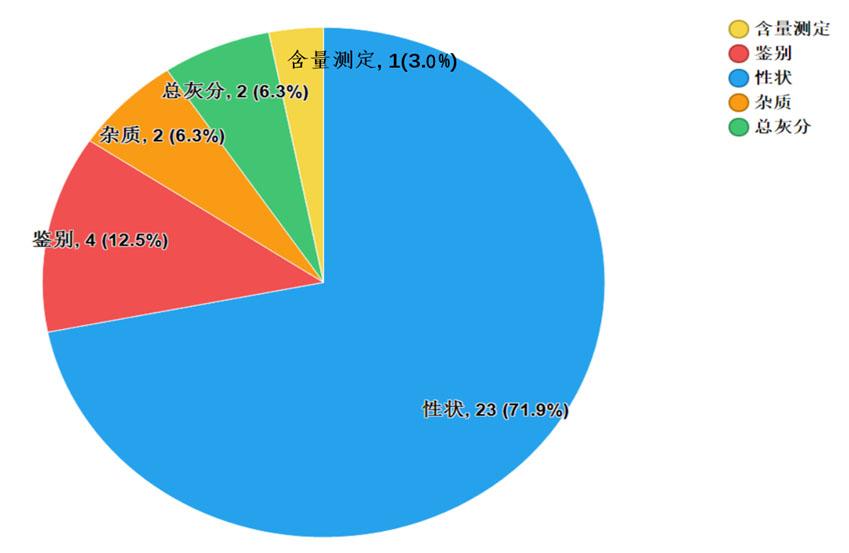
圖16. 2020年中藥飲片專項不符合規定項目分布圖
(注:某些不符合規定產品涉及多個不符合規定項目)
(四)探索性研究
2020年國家藥品抽檢探索性研究發現的主要問題有:一是違法違規生產,個別企業低限、過量或使用替代品投料,違反關鍵制法,質量保障體系缺失以致生產線污染等問題依然存在;二是生產工藝設置不合理或控制系統缺失,導致同一品種質量存在差異;三是部分品種防腐劑、重金屬、農藥殘留超限;四是原藥材與輔料質量控制不嚴,部分企業使用摻偽、染色的原藥材和劣質輔料用于成方制劑生產;五是包裝材料相容性不好影響產品穩定性。
三、抽檢結果應用
藥品抽檢是藥品監督管理部門根據監管需要,依法對生產、經營和使用的藥品及其責任主體所采取的抽查檢驗行為,其根本目的是識別防控風險、消除安全隱患。2020年,藥品監管部門充分利用國家藥品抽檢結果,嚴厲打擊制售假劣藥行為,不斷推動監管機制創新和抽檢數據深度利用,完善藥品抽檢管理體系,提高風險防控能力。
一是嚴格核查處置。2020年,國家藥品抽檢的靶向性進一步提升,基于往年抽檢數據,加大流通環節抽檢力度,保障經營與使用單位藥品質量;同時,遴選臨床用量較大、使用范圍較廣的抗病毒中成藥設置專項抽檢,全年共抽檢抗病毒中成藥品932批次,排查潛在隱患,有效降低了區域性、系統性風險。針對104批次不符合規定的產品,國家藥監局牢固樹立風險意識,第一時間采取查封查扣、暫停銷售等控制措施,并組織各省級藥品管理部門對涉事企業或單位進行調查處理,有力震懾不法企業,凈化市場環境。
二是形成監管合力。為提高藥品抽檢工作服務監管的效能,2020年,國家藥監局不斷推動抽檢數據深度利用,將抽檢結果與檢查、稽查執法等工作有機銜接,形成監管合力。例如,探索性研究發現部分批次復方甘草酸銨注射液抗氧劑超限,經檢查發現個別企業涉嫌擅自違規過量投料;檢驗中發現,部分批次元胡止痛片存在金胺O,經檢查發現個別企業質量控制不嚴,使用劣質藥材投料。不斷提升的檢驗研究水平與高效協同的質量監管體系,有效遏制個別企業的僥幸心理,提高了企業的質量安全意識。
三是完善制度體系。新修訂的《中華人民共和國藥品管理法》《藥品質量抽查檢驗管理辦法》和《藥品抽樣原則及程序》對藥品抽檢工作提出了更高的要求。2020年,國家藥監局組織相關單位完善制度管理體系、創新監管方式方法,一方面對原有的通知文件進行優化整合,印發《國家藥監局關于進一步加強國家藥品抽檢管理工作的通知》并配套制定若干工作程序,構建了相互銜接、上下聯動的全新管理文件體系,暢通管理制度內循環;另一方面,建立專家分析研判機制,對藥品抽檢全周期涉及的品種遴選、異議申訴、質量評議等工作進行綜合研判,確保各項措施的科學性。目前,藥品抽檢專家庫有來自監管、檢驗、審核查驗、不良反應監測、標準制定等多個領域的專家500 余名。
四是加強信息化建設。為提高智慧監管水平,中檢院在國家藥監局帶領下,進一步完善全國藥品抽檢信息平臺建設,充分整合最新信息技術,實現檢驗報告書等相關文件的線上傳遞,確保數據發布與信息傳遞的統一性和規范性;構建即時推送和風險預警模塊,隨時跟蹤工作任務和自動分析抽檢數據。截至目前,國家藥品抽檢工作已實現從品種遴選到核查處置的全生命周期、實時在線管理。此外,為推動數據轉化賦能,平臺將積累的海量數據與深度研究報告向各有關單位開放共享,現已納入抽檢信息154 萬余條,質量分析報告、年度質量狀況報告、專題研究報告等上千冊,為審核查驗、標準提高等監管決策提供了重要參考。不斷提高的信息化建設水平,極大提升了抽檢工作運轉效能,同時為樣品購買等新政策、新要求的順利實施提供有力的技術支撐。
五是促進高質量發展。對于探索性研究發現的一般性問題,藥品監管部門通過“藥品質量提示函”等形式反饋相關企業,不斷推動企業落實主體責任,督促企業提升質量保障體系。例如,消栓再造丸的探索性研究提示,部分批次產品的揮發性成分含量下降可能與原藥材打粉后放置時間過長有關;呋塞米注射液的探索性研究發現,部分企業選取的包裝材料可影響藥品穩定性。在此基礎上,中檢院繼續在官方網站公開國家藥品抽檢的探索性研究情況,2020年共發布63個品種的新建檢驗方法、聯系方式等內容,方便相關單位共享利用,圍繞發現的藥品質量問題和檢驗檢測新技術進行交流,促進行業高質量發展。
六是搭建共治平臺。為深化信息公開,促進社會共治,2020年,國家藥監局繼續以通告的形式,向全社會發布不符合規定產品信息;同時,國家藥監局網站開設抽檢信息查詢平臺,向社會公開國家藥品抽檢結果,并提供相關數據查詢,目前已收錄不符合規定藥品數據1.5萬余條。2020年12月,一年一度的“藥品質量安全年會”以線上形式舉辦,年會基于國家藥品抽檢結果,分析藥品質量狀況,分享最新檢驗檢測技術,助力企業質量管理水平提升,為藥品檢驗機構與相關企業搭建溝通交流平臺,進一步夯實企業主體責任和提升監管效能。
四、結語
2020年,全國藥品監管部門認真落實黨中央、國務院決策部署和國家藥監局有關工作要求,堅持人民至上、保障用藥安全有效、助力疫情防控,順利完成國家藥品抽檢工作。檢驗及研究結果顯示,我國藥品質量仍處于較高水平,整體安全形勢平穩可控。
2021年是“十四五”規劃的開局之年,也是迎接后疫情時代曙光的關鍵之年。國家藥監局將繼續慎終如始抓好疫情防控,扎實做好“六穩”“六保”工作等決策部署,堅持完善藥品抽檢管理體系,不斷創新監管的制度機制和方式方法,認真貫徹落實《中華人民共和國藥品管理法》和《中華人民共和國疫苗管理法》,協同高效做好新形勢下的藥品抽檢工作,著力保障藥品安全形勢穩定。
小貼士
1.藥品抽檢歷史沿革
1956年,我國首次提出藥品計劃抽檢的概念;1964年,原衛生部第一次制定國家級年度藥品抽檢計劃并組織實施;1984年頒布《中華人民共和國藥品管理法》,第一次從法律上明確了藥品抽檢工作的地位;1986年,實行藥品質量公報制度;1990年,實行藥品抽檢收費制度,即抽檢藥品須由被抽檢單位付檢驗費;2001年,《中華人民共和國藥品管理法》修訂,取消了藥品抽檢收費制度,所需費用由財政列支;2019年,《中華人民共和國藥品管理法》再次修訂,明確“藥品監督管理部門根據監督管理的需要,可以對藥品質量進行抽查檢驗”“抽樣應當購買樣品”。
2.藥品標準檢驗
藥品標準檢驗是指具有檢驗資質的藥品檢驗機構,依據國家藥品監督管理部門批準的法定檢驗標準中的檢驗方法,進行全項目或部分項目的檢驗,并依法出具檢驗報告書的過程。
3.探索性研究
探索性研究是指在國家藥品抽檢過程中,除按照國家藥品標準進行檢驗并判定藥品是否符合標準規定之外,針對可能存在的質量問題,應用該品種國家藥品標準以外的檢驗項目和檢測方法對藥品質量進行進一步分析研究的過程。探索性研究結果不作為判定藥品合格與否的依據,可為進一步提升藥品質量水平、加強藥品監管提供技術支持。
4.國家基本藥物
基本藥物是適應基本醫療衛生需求,劑型適宜,價格合理,能夠保障供應,公眾可公平獲得的藥品。國家基本藥物目錄是各級醫療衛生機構配備使用藥品的依據。《國家基本藥物目錄(2018年版)》中的藥品包括化學藥品和生物制品、中成藥、中藥飲片3部分,其中,化學藥品和生物制品主要依據臨床藥理學分類,共 417 個品種;中成藥主要依據功能分類,共268個品種;中藥飲片不列具體品種,頒布國家標準的中藥飲片為國家基本藥物,國家另有規定的除外。
5.藥品補充檢驗方法
藥品檢驗補充檢驗方法和檢驗項目(藥品補充檢驗方法)適用于有摻雜、摻假嫌疑,且國家藥品標準規定的檢驗方法和檢驗項目不能檢驗的藥品檢驗。經國務院藥品監督管理部門批準后,使用補充檢驗方法和檢驗項目所得出的檢驗結果,可以作為藥品監督管理部門認定藥品質量的依據。
6.檢驗項目
性狀項下記載藥品的外觀、臭、味、溶解度以及物理常數等,在一定程度上反映藥品的質量特性。
鑒別項下規定的試驗方法,系根據反映該藥品的某些物理、化學或生物學等特性所進行的藥物鑒別試驗,不完全代表對該藥品化學結構的確認。
檢查項下包括反映藥品的安全性與有效性的試驗方法和限度、均一性與純度等制備工藝要求等內容;對于規定中的各種雜質檢查項目,系指該藥品在按既定工藝進行生產和正常貯藏過程中可能含有或產生并需控制的雜質(如殘留溶劑、有關物質等);改變生產工藝時需另考慮增修訂有關項目。
含量測定項下規定的試驗方法,用于測定原料及制劑中有效成分的含量,一般可采用化學、儀器或生物測定方法。
附件:2020年國家藥品抽檢品種目錄
2020年國家藥品抽檢品種目錄
序號 | 藥品通用名 | 承檢機構 |
1 | 吡嘧司特鉀片、吡嘧司特鉀滴眼液、吡嘧司特鉀分散片 | 安徽省食品藥品檢驗研究院 |
2 | 卡絡磺鈉注射液、注射用卡絡磺鈉 | 安徽省食品藥品檢驗研究院 |
3 | 注射用奈達鉑 | 北京市藥品檢驗所 |
4 | 卡馬西平片、卡馬西平膠囊、卡馬西平緩釋膠囊 | 北京市藥品檢驗所 |
5 | 復方對乙酰氨基酚片 | 重慶市食品藥品檢驗檢測研究院 |
6 | 復方對乙酰氨基酚片(Ⅱ) | 重慶市食品藥品檢驗檢測研究院 |
7 | 氫化可的松注射液 | 成都市食品藥品檢驗研究院 |
8 | 復方三嗪蘆丁片 | 大連市藥品檢驗所 |
9 | 米索前列醇片 | 福建省食品藥品質量檢驗研究院 |
10 | 注射用呋塞米、呋塞米注射液 | 甘肅省藥品檢驗研究院 |
11 | 色甘酸鈉滴眼液 | 甘肅省藥品檢驗研究院 |
12 | 尼扎替丁制劑 | 甘肅省藥品檢驗研究院 |
13 | 雷尼替丁制劑 | 廣東省藥品檢驗所 |
14 | 復方愈創木酚磺酸鉀口服溶液 | 廣西壯族自治區食品藥品檢驗所 |
15 | 復方羅布麻片Ⅰ、復方羅布麻片Ⅱ | 廣州市藥品檢驗所 |
16 | 哈西奈德軟膏、哈西奈德涂膜劑、哈西奈德乳膏 | 海南省藥品檢驗所 |
17 | 硫酸鎂注射液、注射用硫酸鎂 | 海南省藥品檢驗所 |
18 | 唑來膦酸注射液、注射用唑來膦酸 | 河北省藥品檢驗研究院 |
19 | 復方托吡卡胺滴眼液 | 河南省食品藥品檢驗所 |
20 | 注射用炎琥寧 | 河南省食品藥品檢驗所 |
21 | 阿昔洛韋乳膏 | 黑龍江省藥品檢驗研究中心 |
22 | 復方顛茄氫氧化鋁片、復方顛茄氫氧化鋁散 | 黑龍江省藥品檢驗研究中心 |
23 | 鹽酸羥芐唑滴眼液 | 黑龍江省藥品檢驗研究中心 |
24 | 氟康唑氯化鈉注射液 | 湖北省藥品監督檢驗研究院 |
25 | 佐米曲普坦片、佐米曲普坦膠囊、佐米曲普坦口腔崩解片、佐米曲普坦分散片 | 湖北省藥品監督檢驗研究院 |
26 | 氨酚曲馬多膠囊、氨酚曲馬多片 | 湖南省藥品檢驗研究院(湖南藥用輔料檢驗檢測中心) |
27 | 枸櫞酸莫沙必利片、枸櫞酸莫沙必利膠囊、枸櫞酸莫沙必利分散片、枸櫞酸莫沙必利口服溶液 | 吉林省藥品檢驗所 |
28 | 蘭索拉唑腸溶膠囊、蘭索拉唑腸溶片 | 江蘇省食品藥品監督檢驗研究院 |
29 | 注射用艾博韋泰 | 江蘇省食品藥品監督檢驗研究院 |
30 | 鹽酸安羅替尼膠囊 | 江蘇省食品藥品監督檢驗研究院 |
31 | 吡嗪酰胺片 | 江西省藥品檢驗檢測研究院 |
32 | 氨甲苯酸注射液、注射用氨甲苯酸 | 遼寧省藥品檢驗檢測院 |
33 | 磷霉素鈣片、磷霉素鈣顆粒、磷霉素鈣膠囊 | 南京市食品藥品監督檢驗院 |
34 | 膠體果膠鉍膠囊、膠體果膠鉍顆粒 | 寧夏回族自治區藥品檢驗研究院 |
35 | 碘帕醇注射液 | 青島市食品藥品檢驗研究院 |
36 | 小兒氨酚黃那敏片、小兒氨酚黃那敏顆粒 | 青海省藥品檢驗檢測院 |
37 | 泛昔洛韋片、泛昔洛韋膠囊 | 廈門市食品藥品質量檢驗研究院 |
38 | 碘克沙醇注射液 | 山東省食品藥品檢驗研究院 |
39 | 格列吡嗪膠囊、格列吡嗪片 | 山東省食品藥品檢驗研究院 |
40 | 聯苯雙酯滴丸、聯苯雙酯膠囊、聯苯雙酯片 | 山東省食品藥品檢驗研究院 |
41 | 萘敏維滴眼液 | 山西省食品藥品檢驗所 |
42 | 鹽酸氨溴索片、鹽酸氨溴索分散片、鹽酸氨溴索顆粒、鹽酸氨溴索口服溶液 | 陜西省食品藥品監督檢驗研究院 |
43 | 長春西汀注射液、長春西汀氯化鈉注射液、注射用長春西汀 | 陜西省食品藥品監督檢驗研究院 |
44 | 利奈唑胺葡萄糖注射液、利奈唑胺注射液 | 上海市食品藥品檢驗所 |
45 | 注射用奧扎格雷鈉 | 上海市食品藥品檢驗所 |
46 | 氨咖黃敏片、氨咖黃敏膠囊、小兒氨咖黃敏顆粒 | 深圳市藥品檢驗研究院 |
47 | 利巴韋林滴眼液 | 四川省食品藥品檢驗檢測院 |
48 | 鹽酸地爾硫卓注射液、注射用鹽酸地爾硫卓 | 天津市藥品檢驗研究院 |
49 | 馬來酸噻嗎洛爾滴眼液 | 武漢藥品醫療器械檢驗所 |
50 | 鹽酸多西環素片、鹽酸多西環素膠囊、鹽酸多西環素分散片 | 西藏自治區食品藥品檢驗研究院 |
51 | 鹽酸二氧丙嗪片、鹽酸二氧丙嗪顆粒 | 新疆維吾爾自治區藥品檢驗研究院 |
52 | 阿咖酚散、阿咖酚膠囊 | 云南省食品藥品監督檢驗研究院 |
53 | 天麻素注射液、注射用天麻素 | 云南省食品藥品監督檢驗研究院 |
54 | 復方甘草酸銨注射液、復方甘草酸苷注射液、注射用復方甘草酸苷 | 浙江省食品藥品檢驗研究院 |
55 | 纈沙坦制劑 | 浙江省食品藥品檢驗研究院 |
56 | 壬苯醇醚陰道片、壬苯醇醚栓、壬苯醇醚膜、壬苯醇醚凝膠 | 中國食品藥品檢定研究院 |
57 | 煙酰胺注射液、注射用煙酰胺 | 中國食品藥品檢定研究院 |
58 | 對乙酰氨基酚口服液 | 中國食品藥品檢定研究院 |
59 | 鹽酸度洛西汀腸溶膠囊、鹽酸度洛西汀腸溶片 | 中國食品藥品檢定研究院 |
60 | 替加氟注射液 | 中國食品藥品檢定研究院 |
61 | 二甲雙胍制劑 | 中國食品藥品檢定研究院 |
62 | 鹽酸甲氧氯普胺注射液 | 中國人民解放軍聯勤保障部隊藥品儀器監督檢驗總站 |
63 | 阿莫西林克拉維酸鉀片、阿莫西林克拉維酸鉀顆粒、阿莫西林克拉維酸鉀膠囊、阿莫西林克拉維酸鉀分散片 | 重慶市食品藥品檢驗檢測研究院 |
64 | 注射用阿洛西林鈉 | 福建省食品藥品質量檢驗研究院 |
65 | 注射用鹽酸頭孢吡肟 | 廣東省藥品檢驗所 |
66 | 鹽酸環丙沙星片、鹽酸環丙沙星膠囊 | 貴州省食品藥品檢驗所 |
67 | 注射用頭孢西丁鈉 | 河北省藥品檢驗研究院 |
68 | 硫酸阿米卡星注射液、注射用硫酸阿米卡星 | 河南省食品藥品檢驗所 |
69 | 乳酸左氧氟沙星氯化鈉注射液 | 江西省藥品檢驗檢測研究院 |
70 | 克拉霉素片、克拉霉素緩釋片、克拉霉素分散片、克拉霉素膠囊、克拉霉素顆粒 | 山西省食品藥品檢驗所 |
71 | 注射用頭孢哌酮鈉舒巴坦鈉 | 蘇州市藥品檢驗檢測研究中心 |
72 | 鹽酸烏拉地爾注射液 | 西安市食品藥品檢驗所 |
73 | 注射用頭孢唑林鈉、注射用五水頭孢唑林鈉 | 中國食品藥品檢定研究院 |
74 | 依托咪酯注射液、依托咪酯乳狀注射液 | 廣東省藥品檢驗所 |
75 | 注射用糜蛋白酶 | 湖北省藥品監督檢驗研究院 |
76 | 環磷腺苷葡胺注射劑、注射用環磷腺苷葡胺 | 湖南省藥品檢驗研究院(湖南藥用輔料檢驗檢測中心) |
77 | 云芝胞內糖肽膠囊、云芝胞內糖肽片、云芝胞內糖肽口服溶液 | 江蘇省食品藥品監督檢驗研究院 |
78 | 靜注人免疫球蛋白(pH4) | 湖北省藥品監督檢驗研究院 |
79 | 23價肺炎球菌多糖疫苗(注射劑,液體劑型) | 中國食品藥品檢定研究院 |
80 | 流感病毒裂解疫苗、四價流感病毒裂解疫苗 | 中國食品藥品檢定研究院 |
81 | 小兒珍貝散 | 安徽省食品藥品檢驗研究院 |
82 | 柴黃片、柴黃膠囊、柴黃顆粒 | 北京市藥品檢驗所 |
83 | 黃芪注射液 | 常州市食品藥品監督檢驗中心 |
84 | 風熱感冒顆粒(顆粒劑) | 成都市食品藥品檢驗研究院 |
85 | 明目上清丸、明目上清片 | 福建省食品藥品質量檢驗研究院 |
86 | 荊防顆粒 | 甘肅省藥品檢驗研究院 |
87 | 小兒退熱顆粒 | 廣東省藥品檢驗所 |
88 | 石斛夜光丸、石斛夜光顆粒 | 廣西壯族自治區食品藥品檢驗所 |
89 | 消炎靈片、消炎靈膠囊 | 貴州省食品藥品檢驗所 |
90 | 參麥注射液 | 海南省藥品檢驗所 |
91 | 參苓白術片 | 杭州市食品藥品檢驗研究院 |
92 | 四季三黃片、四季三黃丸、四季三黃軟膠囊、四季三黃膠囊 | 河北省藥品檢驗研究院 |
93 | 雙黃連注射液、注射用雙黃連 | 河北省藥品檢驗研究院 |
94 | 護肝片、護肝膠囊、護肝顆粒、護肝丸 | 河南省食品藥品檢驗所 |
95 | 嬰兒健脾顆粒、嬰兒健脾膠囊、嬰兒健脾口服液、嬰兒健脾散 | 湖北省藥品監督檢驗研究院 |
96 | 生脈飲口服液 | 湖南省藥品檢驗研究院(湖南藥用輔料檢驗檢測中心) |
97 | 維血寧顆粒、維血寧合劑、維血寧顆粒(無糖型) | 湖南省藥品檢驗研究院(湖南藥用輔料檢驗檢測中心) |
98 | 枇杷止咳顆粒、枇杷止咳膠囊 | 湖南省藥品檢驗研究院(湖南藥用輔料檢驗檢測中心) |
99 | 強力枇杷露、強力枇杷膠囊、強力枇杷顆粒 | 吉林省藥品檢驗所 |
100 | 芩連顆粒、芩連膠囊、芩連片、芩連丸 | 江蘇省食品藥品監督檢驗研究院 |
101 | 復方鮮竹瀝液 | 江西省藥品檢驗檢測研究院 |
102 | 消旋山茛菪堿滴眼液 | 遼寧省藥品檢驗檢測院 |
103 | 通脈顆粒、通脈口服液 | 遼寧省藥品檢驗檢測院 |
104 | 復方金銀花顆粒、復方金銀花沖劑 | 內蒙古自治區藥品檢驗研究院 |
105 | 三子散、三子顆粒 | 內蒙古自治區藥品檢驗研究院 |
106 | 五加參蛤蚧精口服液 | 寧波市藥品檢驗所 |
107 | 喉痛靈片、喉痛靈顆粒 | 寧夏回族自治區藥品檢驗研究院 |
108 | 養陰清肺顆粒、養陰清肺丸、養陰清肺口服液 | 青島市食品藥品檢驗研究院 |
109 | 六味能消丸、六味能消膠囊、六味能消片 | 青海省藥品檢驗檢測院 |
110 | 愈傷靈膠囊 | 青海省藥品檢驗檢測院 |
111 | 九味羌活膠囊、九味羌活片、九味羌活顆粒、九味羌活丸、九味羌活口服液 | 廈門市食品藥品質量檢驗研究院 |
112 | 腦立清丸、腦立清片、腦立清膠囊 | 山東省食品藥品檢驗研究院 |
113 | 芎菊上清片、芎菊上清顆粒、芎菊上清丸 | 陜西省食品藥品監督檢驗研究院 |
114 | 復方板藍根顆粒 | 上海市食品藥品檢驗所 |
115 | 清開靈注射液、注射用清開靈 | 上海市食品藥品檢驗所 |
116 | 小兒七星茶顆粒、小兒七星茶口服液、小兒七星茶糖漿 | 上海市食品藥品檢驗所 |
117 | 元胡止痛片、元胡止痛膠囊、元胡止痛軟膠囊、元胡止痛顆粒、元胡止痛滴丸、元胡止痛口服液 | 四川省食品藥品檢驗檢測院 |
118 | 六合定中丸 | 蘇州市藥品檢驗檢測研究中心 |
119 | 清熱散結片、清熱散結膠囊 | 天津市藥品檢驗研究院 |
120 | 消栓再造丸 | 無錫市藥品安全檢驗檢測中心 |
121 | 蒲地藍消炎片、蒲地藍消炎膠囊、蒲地藍消炎口服液 | 武漢藥品醫療器械檢驗所 |
122 | 千柏鼻炎片、千柏鼻炎膠囊 | 西藏自治區食品藥品檢驗研究院 |
123 | 柴胡舒肝丸 | 新疆維吾爾自治區藥品檢驗研究院 |
124 | 健兒清解液 | 云南省食品藥品監督檢驗研究院 |
125 | 舒筋活血片、舒筋活血膠囊 | 浙江省食品藥品檢驗研究院 |
126 | 丹參注射液、注射用丹參 | 浙江省食品藥品檢驗研究院 |
127 | 舒筋定痛片 | 中國食品藥品檢定研究院 |
128 | 益心酮片 | 中國食品藥品檢定研究院 |
129 | 黃精 | 安徽省食品藥品檢驗研究院 |
130 | 射干 | 重慶市食品藥品檢驗檢測研究院 |
131 | 前胡 | 大連市藥品檢驗所 |
132 | 秦艽 | 山西省食品藥品檢驗所 |
133 | 紅景天 | 深圳市藥品檢驗研究院 |
134 | 巴戟天 | 中國食品藥品檢定研究院 |
135 | 廣藿香 | 中國食品藥品檢定研究院 |
136 | 制川烏 | 中國食品藥品檢定研究院 |


