2021年度藥品審評報告
2021年是黨和國家歷史上具有里程碑意義的一年。以習近平同志為核心的黨中央團結帶領全黨全國各族人民,隆重慶祝中國共產黨成立一百周年,勝利召開黨的十九屆六中全會、制定黨的第三個歷史決議,如期打贏脫貧攻堅戰,如期全面建成小康社會、實現第一個百年奮斗目標,開啟全面建設社會主義現代化國家、向第二個百年奮斗目標進軍新征程。在“十四五”開局之年,作為我國負責藥品注冊上市的專職技術審評機構,國家藥品監督管理局藥品審評中心(以下簡稱藥審中心)始終堅決貫徹落實習近平總書記重要講話和重要指示精神,全面踐行“四個最嚴”要求,牢記保護和促進公眾健康初心使命,堅持人民至上、生命至上和科學審評,積極投身藥品審評審批制度改革事業,緊緊圍繞人民生命健康、世界科技前沿、國家重大需求等戰略目標,在體制機制、技術標準、流程管理、隊伍建設等方面加快創新融合步伐。
面對復雜嚴峻的疫情防控形勢和極為艱巨繁重的藥品審評任務,藥審中心在國家藥品監督管理局黨組的堅強領導下,以習近平新時代中國特色社會主義思想為指導,深入學習貫徹黨的十九屆五中、六中全會精神和“七一”重要講話精神,認真落實黨中央、國務院決策部署,推動全面從嚴治黨不斷向縱深發展,認真開展好黨史學習教育和“我為群眾辦實事”實踐活動,全力推進新冠病毒疫苗藥物應急審評審批,推動2款國產新冠病毒疫苗接連被納入世界衛生組織(WHO)緊急使用清單(EUL),應急審評通過一組新冠病毒中和抗體聯合治療藥物上市,著力建設公開透明的審評機制,多措并舉支持兒童用藥研發創新,人民獲得感、幸福感、安全感顯著增強。
2021年審評通過47個創新藥,再創歷史新高,臨床急需境外新藥上市持續加快,優先審評效率大幅提高,仿制藥質量和療效一致性評價工作扎實推進,臨床試驗管理躍上新臺階,核查檢驗協調機制更加通暢,實施藥品電子通用技術文檔申報,中國上市藥品專利信息登記平臺建設運行,完成中藥“三方”抗疫成果轉化,完善符合中醫藥特點的審評技術標準體系,支持和推動中藥傳承創新發展,持續深化ICH工作,保障國家藥品監督管理局成功連任ICH管理委員會成員,發布87個技術指導原則,審評標準體系更加完備,流程導向審評體系更加科學,審評體系和審評能力現代化建設持續推進,醫藥產業創新能力和高質量發展進一步增強。
第一章 藥品注冊申請受理情況
(一)總體情況
1.全年受理情況
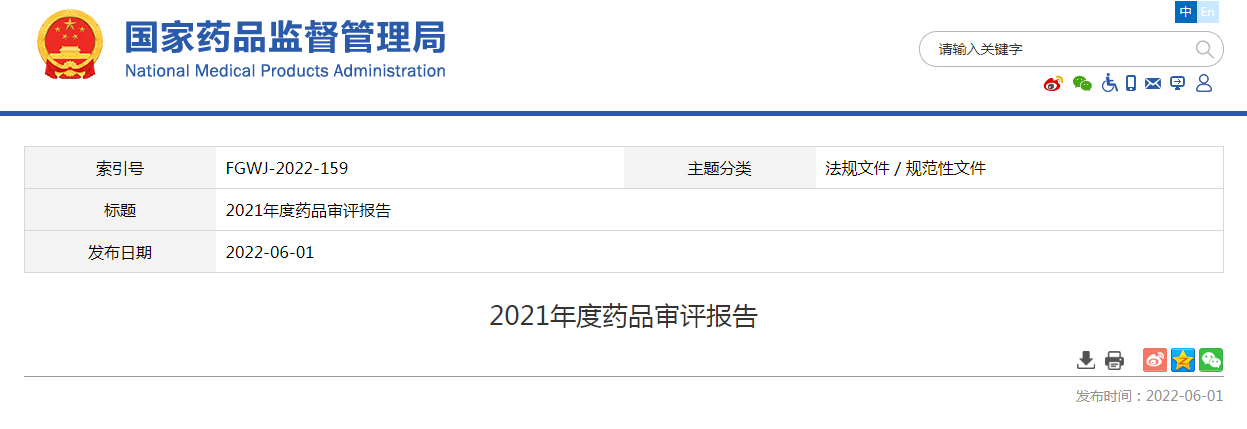
2021年,國家藥品監督管理局藥品審評中心(以下簡稱藥審中心)受理注冊申請11658件1,同比增長13.79%。
受理需技術審評的注冊申請9235件,同比增長29.11%,包括需經技術審評后報送國家局2審批(以下簡稱技術審評)的注冊申請2180件,需經技術審評后以國家局名義作出行政審批(以下簡稱審評審批)的注冊申請7051件,需經技術審評后送國家藥品監督管理局醫療器械技術審評中心、以醫療器械作用為主的藥械組合(以下簡稱藥械組合)產品的注冊申請4件。
受理無需技術審評直接以國家局名義作出行政審批3(以下簡稱直接審批)的注冊申請2423件。2017-2021年注冊申請受理量詳見圖1。
根據《國家藥監局關于進一步完善藥品關聯審評審批和監管工作有關事宜的公告》(2019年第56號,以下簡稱56號公告)要求,2021年受理原料藥注冊申請1313件,同比增長2.98%。
2.需技術審評的各類注冊申請受理情況
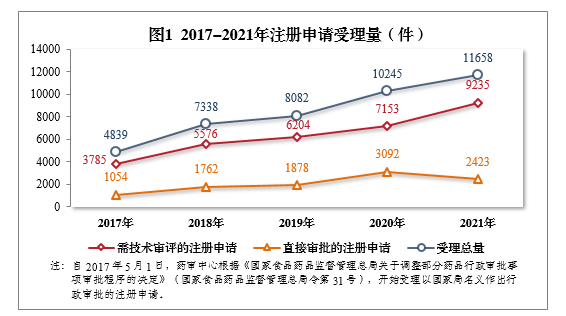
2021年受理的需技術審評的9231件4注冊申請中,以藥品類型統計,中藥5注冊申請444件,同比增長40.95%;化學藥注冊申請為6788件,同比增長25.66%,占全部需技術審評的注冊申請受理量的73.53%;生物制品注冊申請1999件,同比增長39.79%。2017-2021年需技術審評的各藥品類型注冊申請受理量詳見圖2。
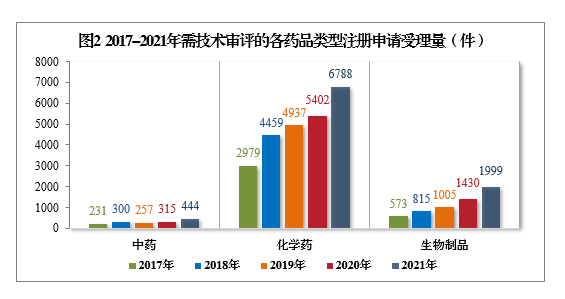
以注冊申請類別統計,受理新藥臨床試驗申請(該注冊申請類別以下簡稱IND)2412件,同比增長55.81%;新藥上市許可申請(該注冊申請類別以下簡稱NDA)389件,同比增長20.43%;同名同方藥、仿制藥、生物類似藥上市許可申請(該注冊申請類別以下簡稱ANDA)1791件,同比增長59.06%;仿制藥質量和療效一致性評價注冊申請6(該注冊申請類別以下簡稱一致性評價申請)908件;補充申請3283件,同比增長16.13%。2017-2021年需技術審評的各類別注冊申請受理量詳見圖3。
(二)創新藥注冊申請受理情況
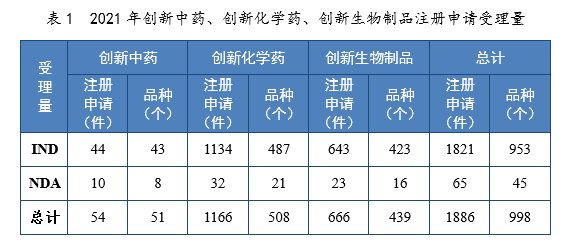
2021年受理創新藥7注冊申請1886件(998個品種8),同比增長76.10%。
以藥品類型統計,創新中藥54件(51個品種),同比增長134.78%;創新化學藥1166件(508個品種),同比增長55.05%;創新生物制品666件(439個品種),同比增長125.00%。
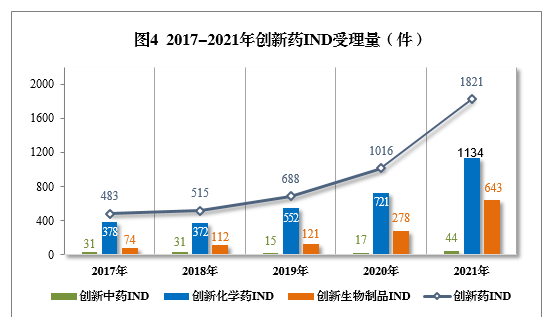
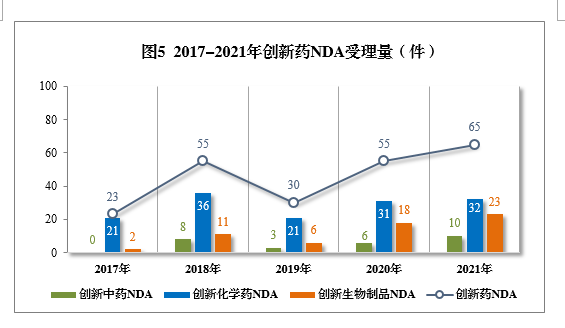
以注冊申請類別統計,IND 1821件(953個品種),同比增長79.23%;NDA 65件(45個品種),同比增長18.18%。
2021年創新中藥、創新化學藥、創新生物制品注冊申請受理量詳見表1,2017-2021年創新藥IND受理量詳見圖4,2017-2021年創新藥NDA受理量詳見圖5。
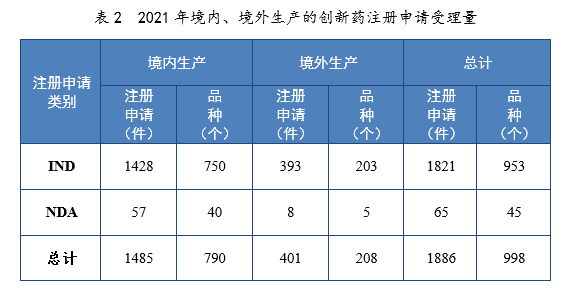
以生產場地類別統計,境內生產創新藥1485件(790個品種),境外生產創新藥401件(208個品種)。2021年境內、境外生產的創新藥注冊申請受理量詳見表2。
(三)需技術審評的中藥注冊申請受理情況
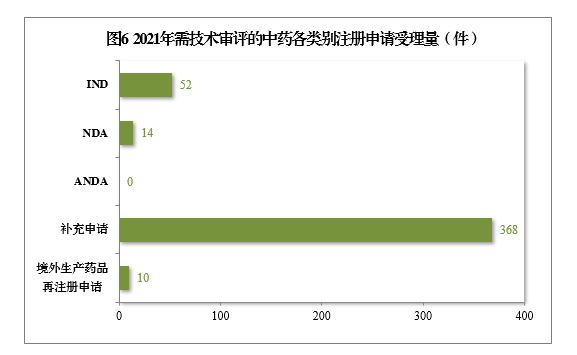
2021年受理需技術審評的中藥注冊申請444件。以注冊申請類別統計,IND 52件,同比增長136.36%,包括創新中藥IND 44件(43個品種),同比增長158.82%;NDA 14件,同比增長133.33%,包括創新中藥NDA 10件(8個品種),同比增長66.67%。
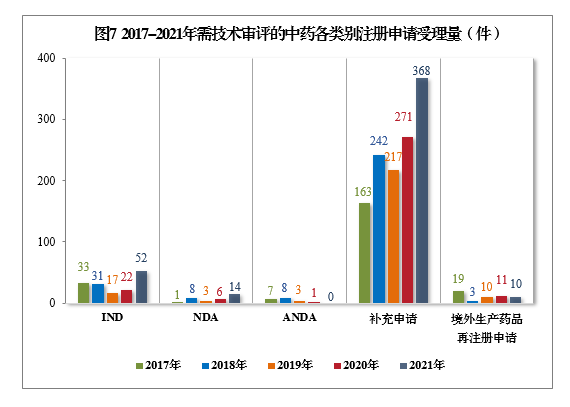
2021年需技術審評的中藥各類別注冊申請受理量詳見圖6。2017-2021年需技術審評的中藥各類別注冊申請受理量詳見圖7。
(四)需技術審評的化學藥注冊申請受理情況
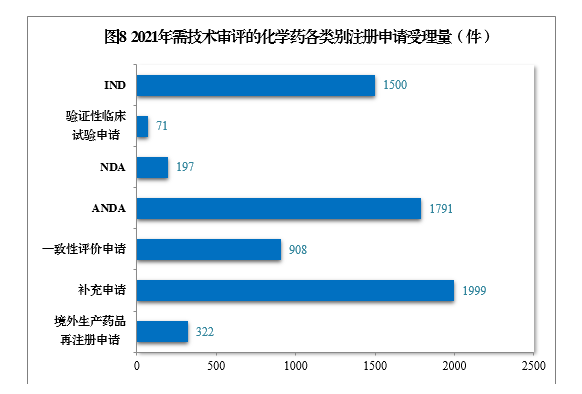
2021年受理需技術審評的化學藥注冊申請6788件。以注冊申請類別統計,IND 1500件,同比增長58.56%,包括創新化學藥IND 1134件(487個品種),同比增長57.28%;NDA 197件,同比增長3.14%,包括創新化學藥NDA 32件(21個品種),同比增長3.23%;化學藥5.1類9注冊申請169件,同比增長5.63%,其中臨床試驗申請10共44件,NDA 125件;ANDA 1791件,同比增長59.20%;一致性評價申請908件。
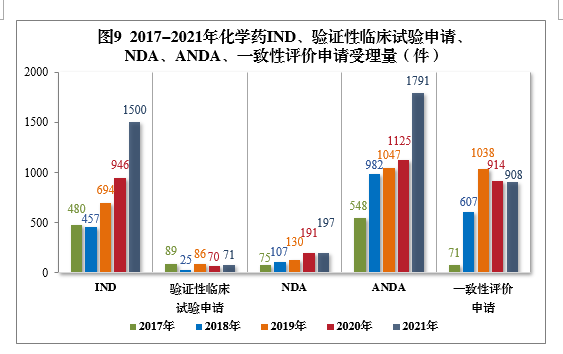
2021年需技術審評的化學藥各類別注冊申請受理量詳見圖8。2017-2021年化學藥IND、驗證性臨床試驗申請、NDA、ANDA、一致性評價申請受理量詳見圖9。
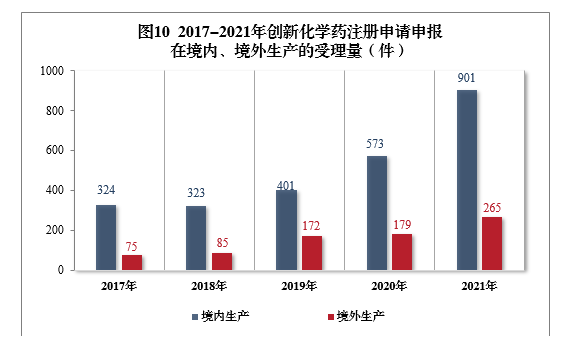
需技術審評的創新化學藥注冊申請共1166件(508個品種)11中,以生產場地類別統計,901件(385個品種)申報在境內生產,265件(123個品種)申報在境外生產。2017-2021年創新化學藥注冊申請申報在境內、境外生產的受理量詳見圖10。
(五)需技術審評的生物制品注冊申請受理情況
2021年受理需技術審評的生物制品注冊申請1999件,其中,預防用生物制品注冊申請229件、治療用生物制品注冊申請1755件和體外診斷試劑15件。以注冊申請類別統計:
IND 860件,同比增長48.28%,包括創新生物制品IND 643件(423個品種),同比增長131.29%。其中,預防用生物制品IND 45件,包括創新預防用生物制品IND 26件(16個品種),治療用生物制品IND 815件,包括創新治療用生物制品IND 617件(407個品種)。
NDA 178件,同比增長41.27%,包括創新生物制品NDA 23件(16個品種),同比增長27.78%。其中,預防用生物制品NDA 13件,包括創新預防用生物制品NDA 5件(2個品種);治療用生物制品NDA 156件,包括創新治療用生物制品18件(14個品種);體外診斷試劑9件。
補充申請916件。境外生產藥品再注冊申請45件。
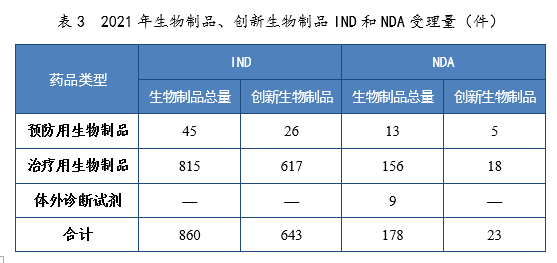
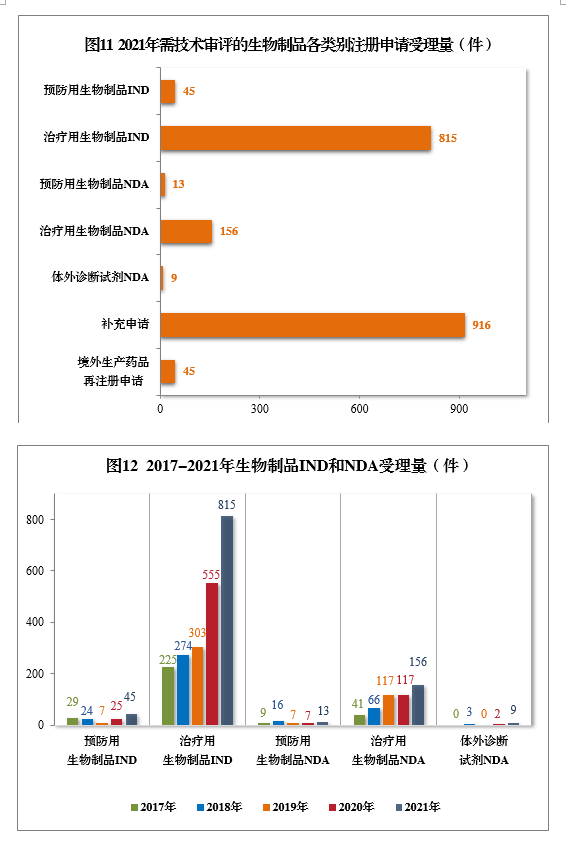
2021年生物制品、創新生物制品IND和NDA受理量詳見表3。2021年需技術審評的生物制品各類別注冊申請受理量詳見圖11。2017-2021年生物制品IND和NDA受理量詳見圖12。
表3 2021年生物制品、創新生物制品IND和NDA受理量(件)
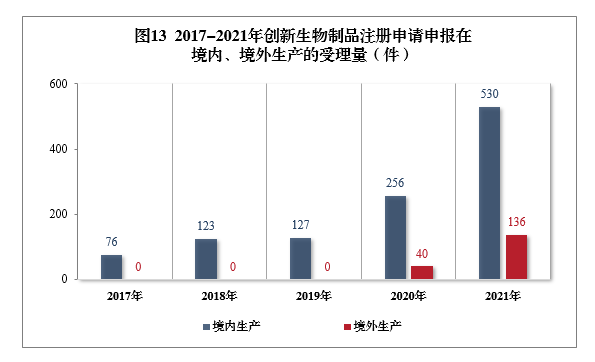
需技術審評的創新生物制品注冊申請共666件(439個品種12)中,以生產場地類別統計,境內生產創新生物制品注冊申請530件(354個品種),境外生產創新生物制品注冊申請136件(85個品種)。2017-2021年創新生物制品注冊申請申報在境內、境外生產的受理量詳見圖13。
(六)行政審批注冊申請受理情況
1.總體情況
2021年受理行政審批注冊申請9474件,同比增長7.82%。其中,直接審批的注冊申請2423件;審評審批的注冊申請137051件,同比增長23.81%,包括臨床試驗申請2483件,同比增長53.46%。
2021年行政審批注冊申請受理量詳見表4。201714-2021年行政審批注冊申請受理量詳見圖14。
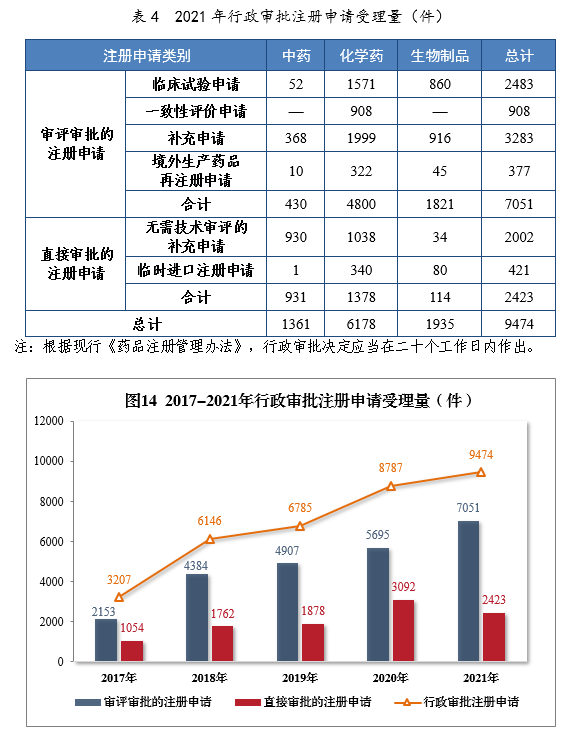
2.審評審批的注冊申請受理情況
2021年受理審評審批的注冊申請7051件,以藥品類型統計,中藥注冊申請430件,同比增長40.07%;化學藥注冊申請4800件,同比增長17.50%,占全部審評審批的注冊申請受理量的68.08%;生物制品注冊申請1821件,同比增長39.75%。
以注冊申請類別統計,臨床試驗申請2483件,同比增長53.46%;一致性評價申請908件;補充申請3283件,同比增長16.13%;境外生產藥品再注冊申請377件,同比增長14.94%。
3.直接審批的注冊申請受理情況
2021年受理直接審批的注冊申請2423件,以藥品類型統計,中藥注冊申請931件、化學藥注冊申請1378件、生物制品注冊申請114件。以注冊申請類別統計,補充申請2002件、臨時進口注冊申請421件。
第二章 藥品注冊申請審評審批情況
(一)總體情況
1.全年審評審批工作情況
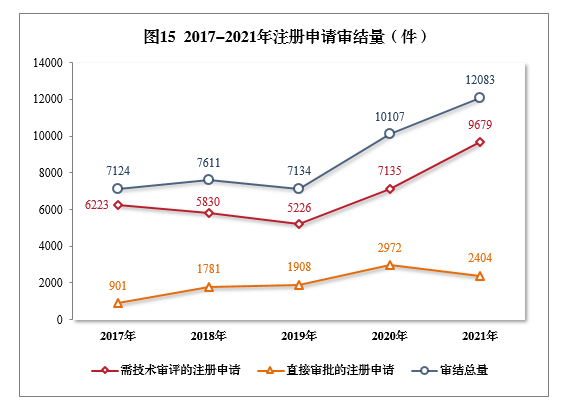
2021年審結的15注冊申請共12083件16,同比增長19.55%。
審結的需技術審評的注冊申請9679件,同比增長35.66%,包括技術審評的注冊申請2632件,審評審批的注冊申請7039件,藥械組合注冊申請8件。
審結直接審批的注冊申請2404件。2017-2021年注冊申請審結量詳見圖15。
截至2021年底,有5652件注冊申請正在審評審批中;待申請人回復補充資料1353件。根據56號公告,2021年審結原料藥注冊申請494件。截至2021年底,有1302件原料藥注冊申請正在審評審批中;待申請人回復補充資料582件。
2.需技術審評的各類注冊申請審結情況
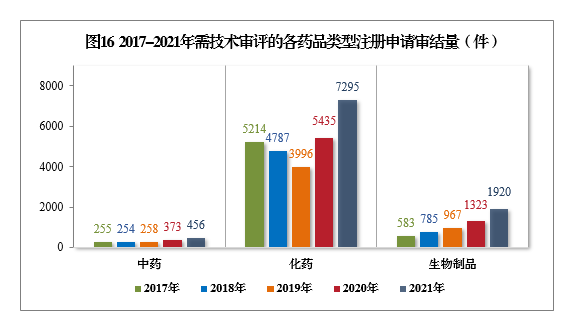
2021年審結的需技術審評的9671件17注冊申請中,以藥品類型統計,中藥注冊申請456件,同比增長22.25%;化學藥注冊申請7295件,同比增長34.22%,占全部需技術審評審結量的75.43%;生物制品注冊申請1920件,同比增長45.12%。
2017-2021年需技術審評的各藥品類型注冊申請審結量詳見圖16。
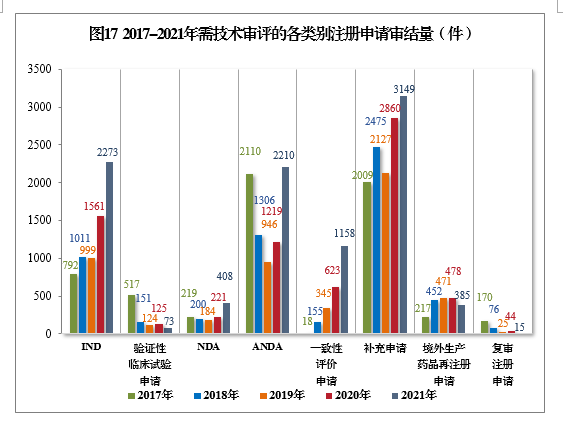
以注冊申請類別統計,IND 2273件,同比增長45.61%;NDA 408件,同比增長84.62%;ANDA 2210件,同比增長81.30%;一致性評價申請1158件,同比增長85.87%;補充申請3149件,同比增長10.10%。2017-2021年需技術審評的各類別注冊申請審結量詳見圖17。
3.批準/建議批準情況
2021年批準IND 2108件,同比增長46.90%;建議批準NDA 323件(見附件1),同比增長55.29%;建議批準ANDA 1003件,同比增長9.26%;批準一致性評價申請1080件,同比增長87.18%。各類別注冊申請批準/建議批準量詳見表5。
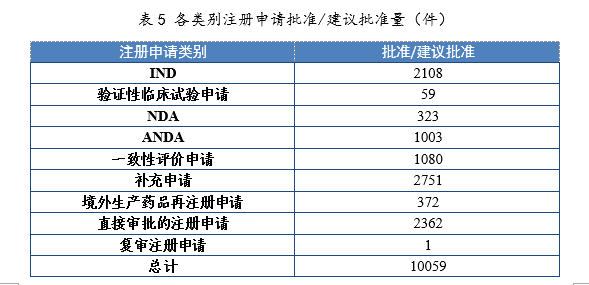
建議批準境外生產原研藥1876個品種(含新增適應癥品種,見附件2)。
臨床急需境外新藥81個品種19中,截至2021年底,已有54個品種提出注冊申請,51個品種獲批上市,按審評時限審結率(以下簡稱按時限審結率)100%,臨床急需境外新藥審評審批情況見附件3。
4.各類別注冊申請按時限審結情況
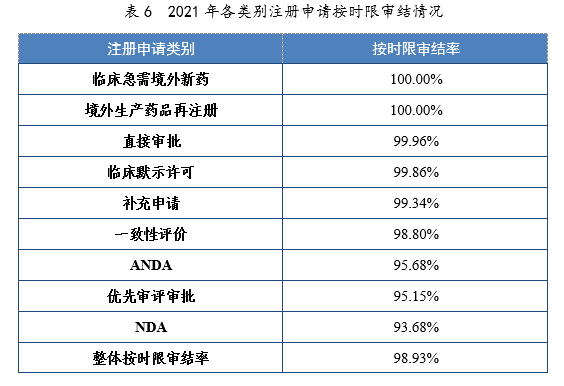
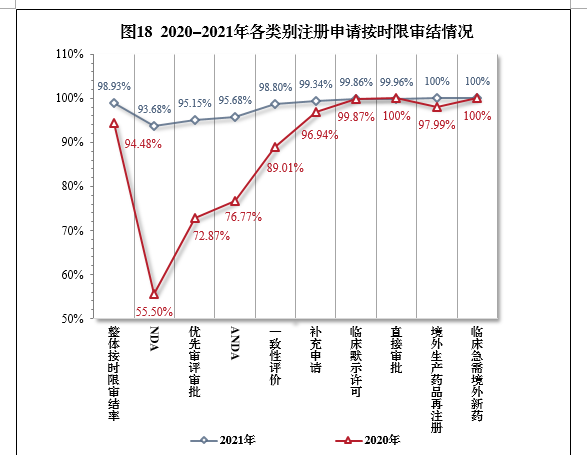
2021年,藥審中心持續優化審評流程、嚴格審評時限管理、加快審評速度、強化項目督導,全年整體按時限審結率98.93%。其中NDA、ANDA、納入優先審評審批程序的注冊申請按時限審結率均超過90%,取得歷史性突破。2021年各類別注冊申請按時限審結情況詳見表6,2020-2021年各類別注冊申請按時限審結情況詳見圖18。
(二)創新藥注冊申請審結情況
1.總體情況
2021年審結創新藥20注冊申請1744件(943個品種),同比增長67.85%。
以藥品類型統計,創新中藥55件(55個品種),同比增長52.78%;創新化學藥1085件(484個品種),同比增長45.44%;創新生物制品604件(404個品種),同比增長135.02%。
以注冊申請類別統計,IND 1663件(885個品種),同比增長67.14%;NDA 81件(58個品種),同比增長84.09%。
2.批準/建議批準情況
2021年批準/建議批準創新藥注冊申請1628件(878個品種),同比增長67.32%。
以藥品類型統計,創新中藥39件(39個品種),同比增長39.29%;創新化學藥1029件(463個品種),同比增長44.32%;創新生物制品560件(376個品種),同比增長141.38%。以注冊申請類別統計,IND 1559件(831個品種),同比增長65.32%,NDA 69件(47個品種,見附件4),同比增長130.00%。
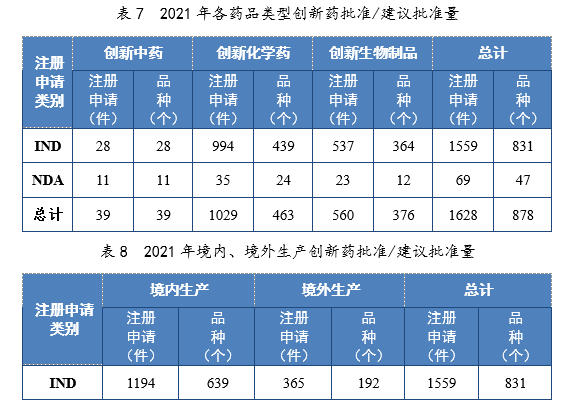
以生產場地類別統計,境內生產創新藥1261件(684個品種),同比增長60.84%;境外生產創新藥367件(194個品種),同比增長94.18%。2021年各藥品類型創新藥批準/建議批準量詳見表7,2021年境內、境外生產創新藥批準/建議批準量詳見表8,2017-2021年創新藥IND批準量詳見圖19,2017-2021年創新藥NDA建議批準量詳見圖20。
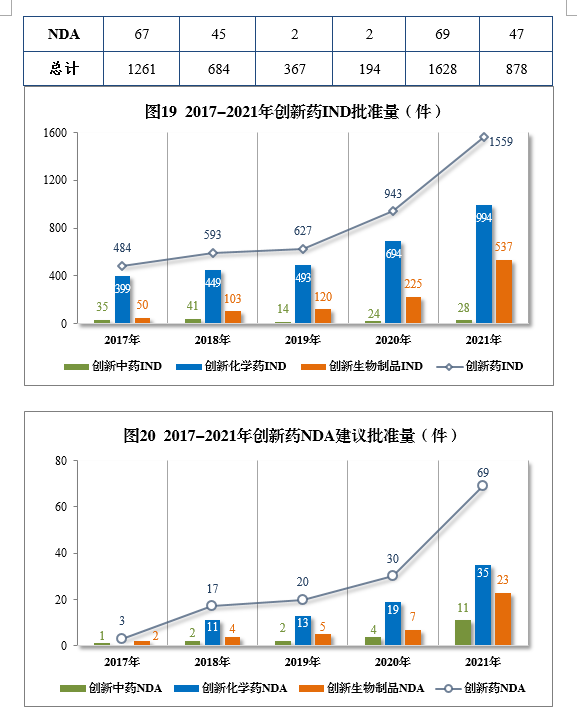
(三)需技術審評的中藥注冊申請審結情況
1.總體情況
2021年審結需技術審評的中藥注冊申請456件,同比增長22.25%。以注冊申請類別統計,IND 49件,同比增長32.43%;NDA 19件,同比增長216.67%;ANDA 3件。2021年需技術審評的中藥各類別注冊申請審結量詳見圖21。
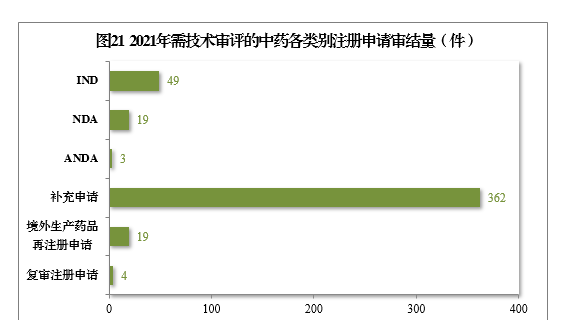
2.批準/建議批準情況
2021年審結的中藥IND中,批準34件,不批準9件。審結的中藥NDA中,建議批準14件,建議不批準3件。2021年需技術審評的中藥注冊申請審結情況詳見表9。
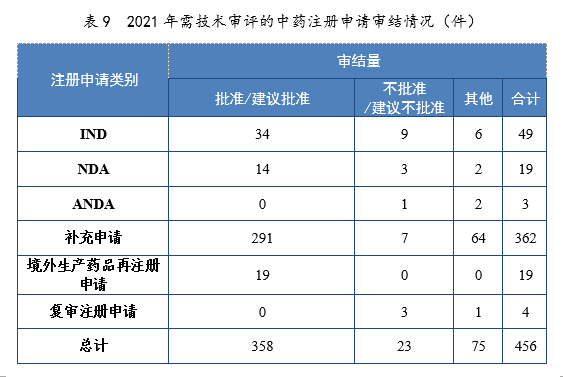
注:“其他”是指申請人未按規定繳納費用、撤回申請等原因導致審評審批終止的情形。
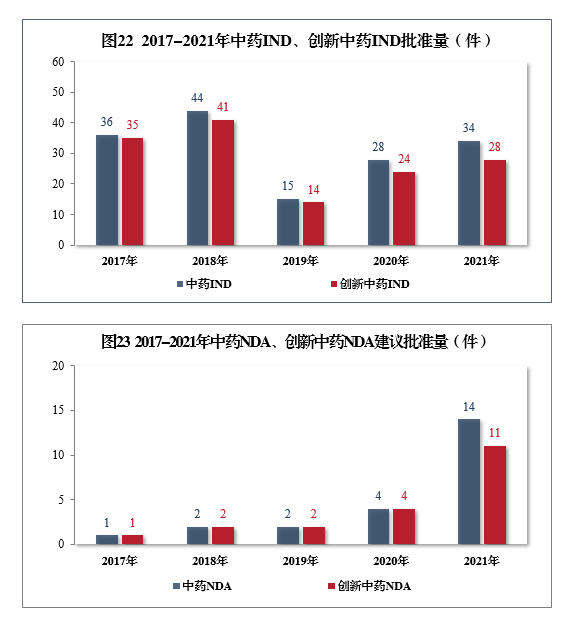
批準中藥IND 34件,同比增長21.43%,包括創新中藥IND 28件(28個品種),同比增長16.67%;建議批準中藥NDA 14件,同比增長250.00%,創5年以來新高,包括創新中藥NDA 11件(11個品種),同比增長175.00%。2017-2021年中藥IND、創新中藥IND批準量詳見圖22,2017-2021年中藥NDA、創新中藥NDA建議批準量詳見圖23。
批準的34件中藥IND中,涉及13個適應癥領域,其中消化8件、呼吸6件、婦科4件,共占52.94%,2021年批準中藥IND的適應癥領域分布量詳見圖24。
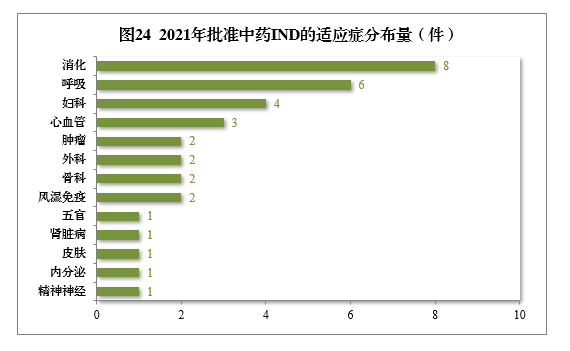
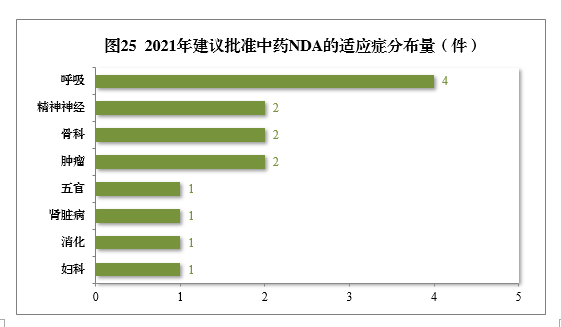
建議批準的中藥NDA 14件中,呼吸腫瘤、精神神經、骨科藥物較多,占全部中NDA批準量的71.43%。
2021年建議批準中藥NDA的適應癥分布量詳見圖25。
(四)需技術審評的化學藥注冊申請審結情況
1.總體情況
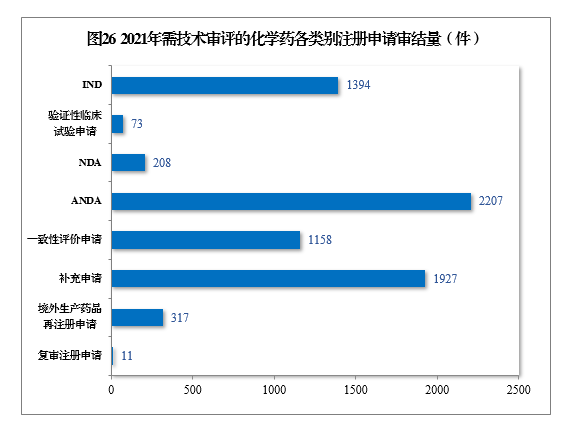
2021年審結需技術審評的化學藥注冊申請7295件。以注冊申請類別統計,化學藥臨床試驗申請1467件,同比增長35.21%;化學藥NDA 208件,同比增長67.74%;化學藥ANDA 2207件,同比增長81.50%;化學藥一致性評價申請1158件,同比增長85.87%。2021年需技術審評的化學藥各類別注冊申請審結量詳見圖26。
2.批準/建議批準情況
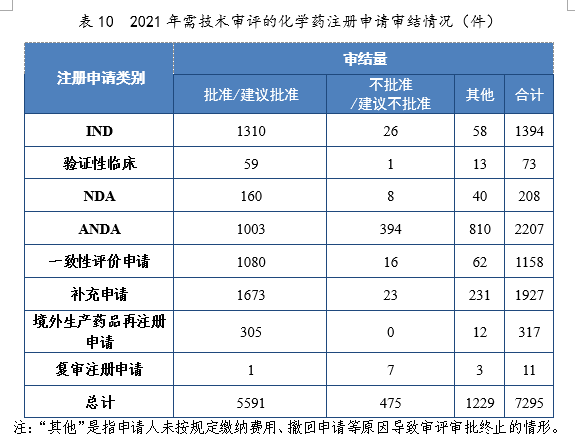
2021年審結的化學藥IND中,批準1310件,不批準26件。審結的化學藥NDA中,建議批準160件,建議不批準8件。審結的化學藥ANDA中,建議批準1003件,建議不批準394件。2021年需技術審評的化學藥注冊申請審結情況詳見表10。
批準化學藥IND 1310件,同比增長44.43%,其中創新化學藥IND 994件(439個品種),同比增長43.23%。2017-2021年化學藥IND、創新化學藥IND批準量詳見圖27。
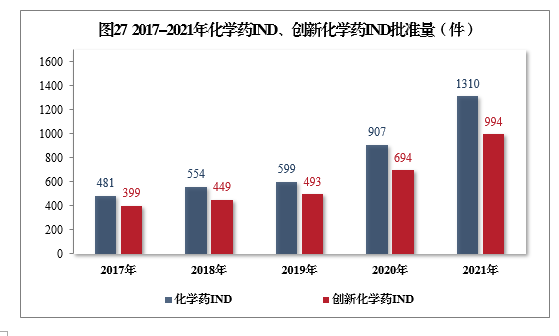
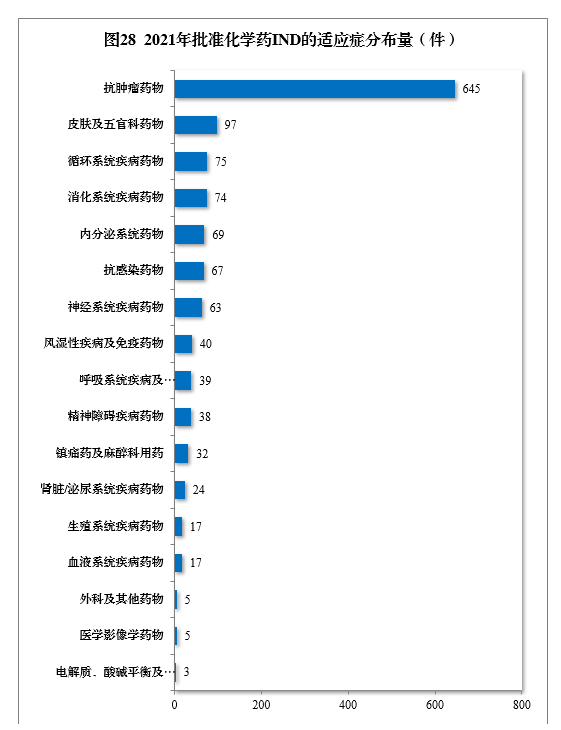
批準的化學藥IND 1310件中,抗腫瘤藥物、皮膚及五官科藥物、循環系統疾病藥物、消化系統疾病藥物、內分泌系統藥物、抗感染藥物和神經系統疾病藥物較多,占全部化學藥IND批準量的83.21%。2021年批準化學藥IND的適應癥分布量詳見圖28。
建議批準化學藥NDA 160件,同比增長39.13%,包括創新化學藥35件(24個品種),同比增長84.21%;建議批準化學藥ANDA 1003件,同比增長9.26%。2017-2021年化學藥NDA、創新化學藥NDA建議批準量詳見圖29。
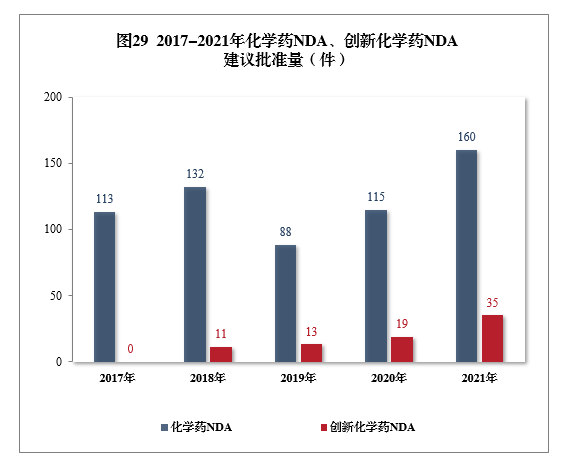
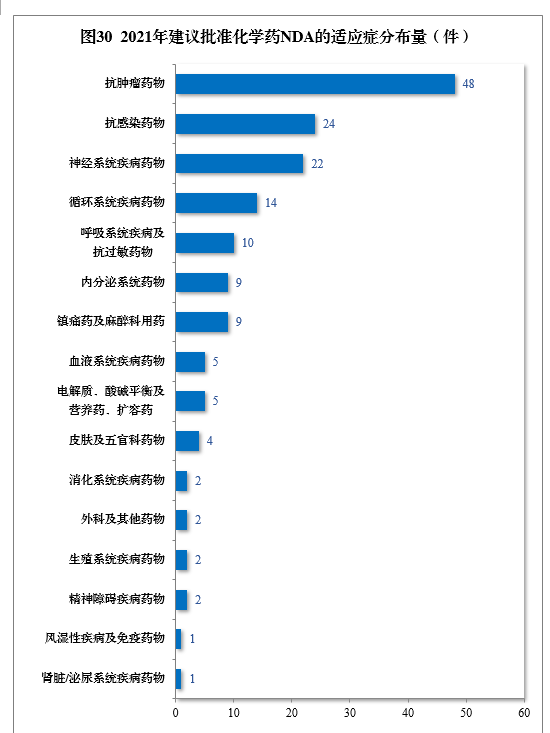
建議批準的化學藥NDA 160件中,抗腫瘤藥物、抗感染藥物、神經系統疾病藥物、循環系統疾病藥物、呼吸系統疾病及抗過敏藥物藥物較多,占全部化學藥NDA批準量的73.75%。2021年建議批準化學藥NDA的適應癥分布量詳見圖30。
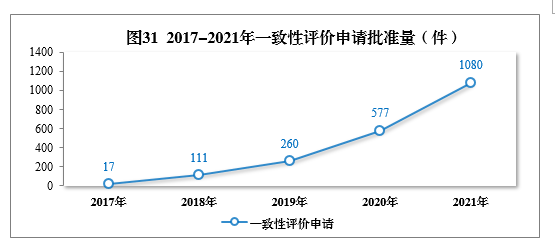
審結一致性評價申請共1158件,批準1080件。其中口服固體制劑一致性評價申請391件,注射劑一致性評價申請689件,2017-2021年一致性評價申請批準量詳見圖31。2021年批準的一致性評價品種見附件5。
(五)需技術審評的生物制品注冊申請審結情況
1.總體情況
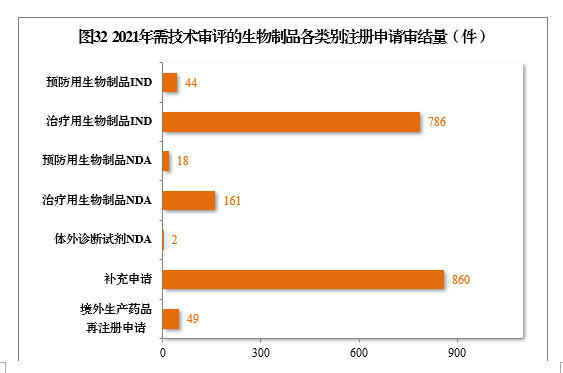
2021年,審結1920件需技術審評的生物制品注冊申請,其中,預防用生物制品234件和治療用生物制品1676件,體外診斷試劑10件。以注冊申請類別統計,IND 830件,同比增長47.16%,NDA 181件,同比增長98.90%,補充申請860件,境外生產藥品再注冊申請49件。2021年需技術審評的生物制品各類別注冊申請審結量詳見圖32。
2.批準/建議批準情況
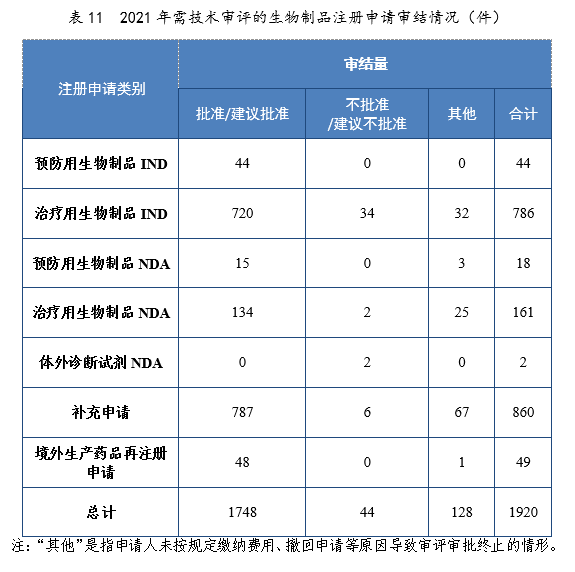
2021年審結的生物制品IND中,批準764件,不批準34件。審結的生物制品NDA中,建議批準149件,建議不批準4件。2021年需技術審評的生物制品注冊申請審結情況詳見表11。
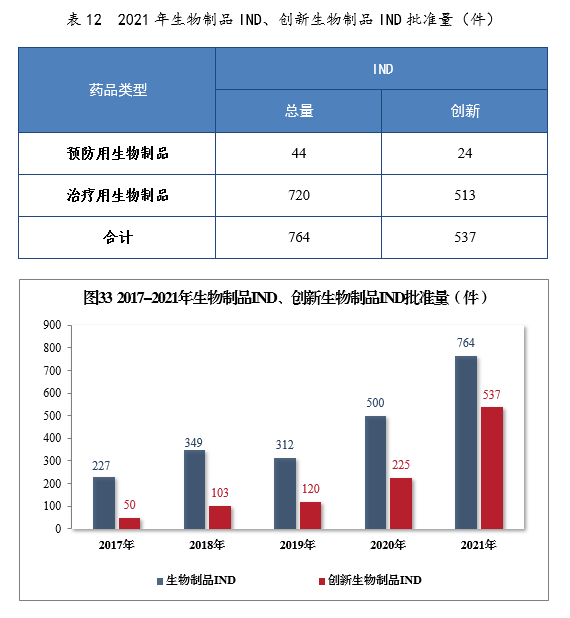
批準生物制品IND 764件,同比增長52.80%,包括創新生物制品IND 537件(364個品種),同比增長138.67%。其中,預防用生物制品IND 44件,同比增長131.58%,包括創新預防用生物制品IND 24件(16個品種),同比增長800%;治療用生物制品IND 720件,同比增長49.69%,包括創新治療用生物制品IND 513件(348個品種),同比增長131.08%。2021年生物制品IND、創新生物制品IND批準量詳見表12。2017-2021年生物制品IND、創新生物制品IND批準量詳見圖33。
批準的生物制品IND 764件中,抗腫瘤藥物較多,占全部生物制品IND批準量的58.77%。2021年批準生物制品IND的適應癥分布量詳見圖34。
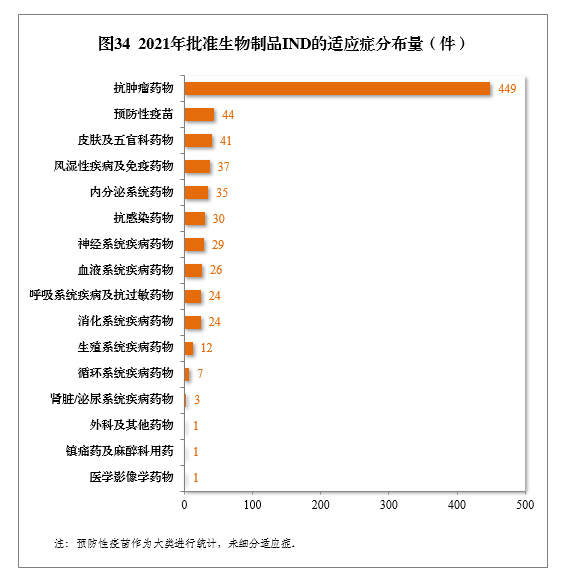
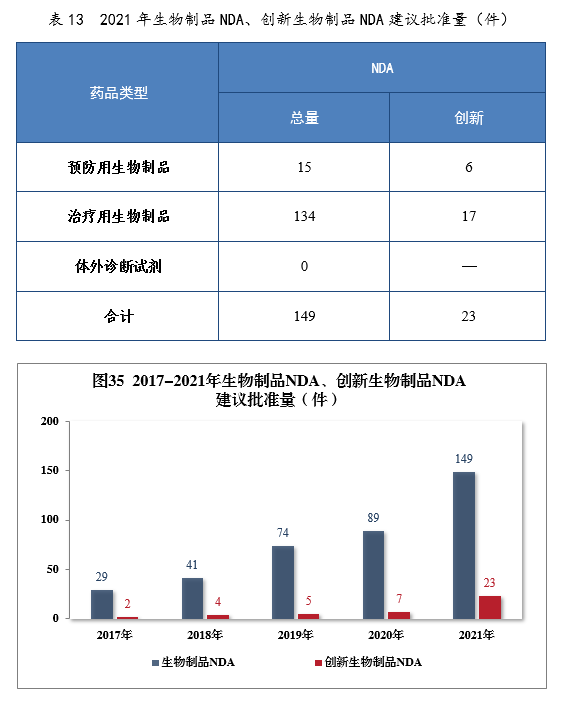
建議批準生物制品NDA 149件,同比增長67.42%,包括創新生物制品NDA 23件(12個品種),同比增長228.57%。其中,預防用生物制品NDA 15件,同比增長114.29%,包括創新預防用生物制品NDA 6件(3個品種);治療用生物制品NDA 134件,同比增長65.43%,包括創新治療用生物制品NDA 17件(9個品種),同比增長142.86%。2021年生物制品NDA、創新生物制品NDA建議批準量詳見表13。2017-2021年生物制品NDA、創新生物制品NDA通過批準量詳見圖35。
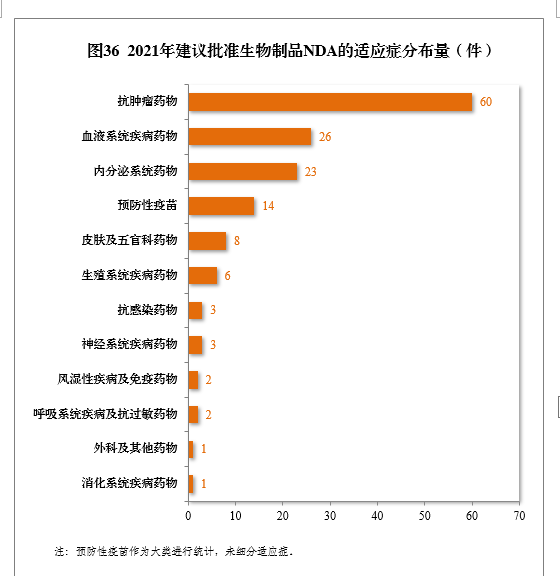
建議批準的生物制品NDA 149件中,抗腫瘤、血液系統、內分泌系統藥物、疫苗較多,占全部生物制品NDA批準量的82.55%。2021年建議批準生物制品NDA的適應癥分布量詳見圖36。
(六)行政審批注冊申請審結情況
1.總體情況
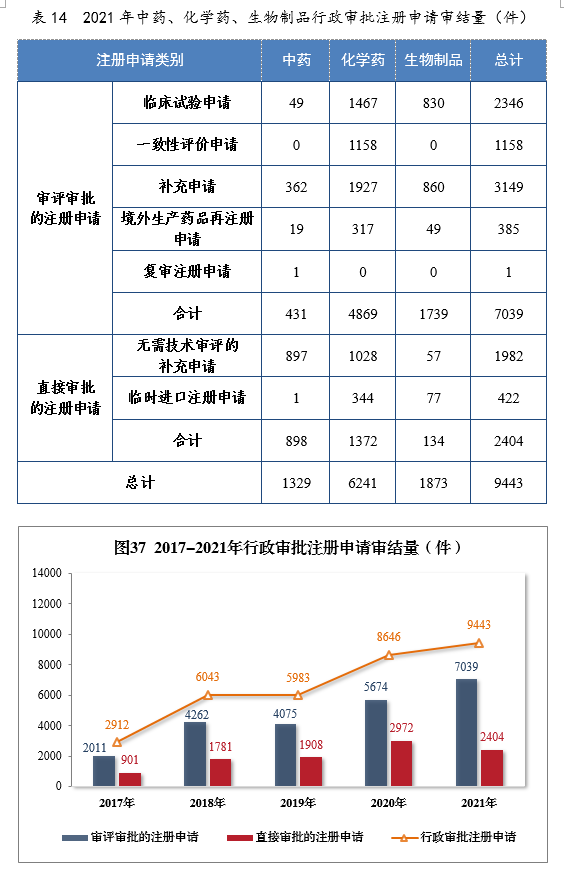
2021年審結行政審批注冊申請9443件,同比增長9.22%。審評審批的注冊申請217039件,同比增長24.06%;直接審批的注冊申請222404件。2021年中藥、化學藥、生物制品行政審批注冊申請審結量詳見表14。2017-2021年需行政審批注冊申請審結量詳見圖37。
2.審評審批的注冊申請審結情況
審評審批的7039件注冊申請中,以藥品類型統計,中藥注冊申請431件,同比增長20.73%;化學藥注冊申請為4869件,同比增長19.16%,占全部審評審批審結量的69.17%;生物制品注冊申請1739件,同比增長41.27%。以注冊申請類別統計,臨床試驗申請2346件,同比增長39.15%;一致性評價申請1158件,同比增長85.87%;補充申請3149件,同比增長10.10%;境外生產藥品再注冊申請385件、復審注冊申請1件。
3.直接審批的注冊申請審結情況
直接審批的2404件注冊申請中,以藥品類型統計,中藥注冊申請898件、化學藥注冊申請1372件、生物制品注冊申請134件。以注冊申請類別統計,補充申請1982件、臨時進口注冊申請422件。
(七)藥品注冊核查情況
2021年合規審查8526件注冊申請,以注冊申請類別統計,NDA 617件,ANDA 2375件,一致性評價申請1687件,補充申請2423件,原料藥注冊申請1424件。
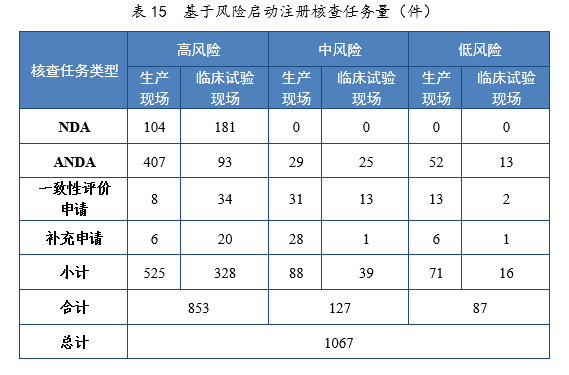
2021年基于風險共啟動注冊核查任務231067件,包括藥品注冊生產現場(以下簡稱生產現場)核查任務684件,藥物臨床試驗現場(以下簡稱臨床試驗現場)核查任務383件;以注冊申請類別統計,NDA核查任務285件,ANDA核查任務619件,一致性評價申請核查任務101件,補充申請核查任務62件。基于風險啟動注冊核查任務量詳見表15。
此外,啟動了新冠病毒治療藥物、新冠病毒疫苗的現場核查、有因檢查34次。
2021年國家藥品監督管理局食品藥品審核查驗中心共返回藥審中心各類核查報告1165件。
第三章 藥品加快上市注冊程序和溝通交流情況
(一)藥品加快上市注冊程序情況
1.突破性治療藥物程序
2021年受理的注冊申請中,申請適用突破性治療藥物程序的注冊申請263件。經綜合評估、公示,53件(41個品種)納入突破性治療藥物程序,覆蓋了新型冠狀病毒感染引起的疾病、非小細胞肺癌、卵巢癌等適應癥。2021年藥審中心突破性治療藥物程序納入情況詳見附件6。2021年建議批準的NDA中,有5件被納入了突破性治療藥物程序得以加快上市。
2.附條件批準程序
2021年建議批準的323件NDA中,共有60件(38個品種)經附條件批準后上市,占比18.58%。2021年新藥上市許可的附條件批準情況詳見附件1。
3.優先審評審批程序
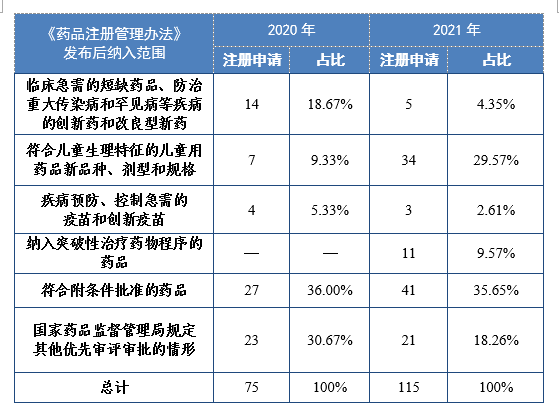
根據現行《藥品注冊管理辦法》,2021年共115件注冊申請(69個品種)納入優先審評審批程序。其中,符合附條件批準的藥品41件,占比35.65%,符合兒童生理特征的兒童用藥品新品種、劑型和規格34件,占比29.57%。藥審中心優先審評資源逐年加大向具有臨床優勢的新藥、兒童用藥、罕見病藥物注冊申請傾斜。
2020-2021年根據現行《藥品注冊管理辦法》納入優先審評審批程序的注冊申請量詳見表16。
表16 2020-2021年根據現行《藥品注冊管理辦法》納入優先審評審批程序的注冊申請量(件)
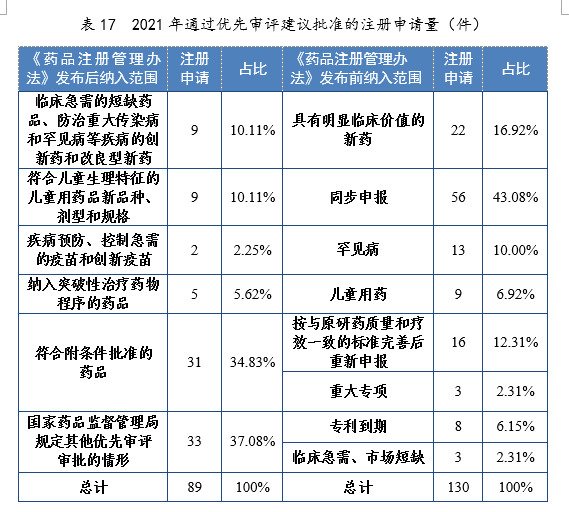
已納入優先審評審批程序的注冊申請中,2021年有219件(131個品種)建議批準上市。按照現行《藥品注冊管理辦法》發布前納入范圍,130件注冊申請已納入優先審評審批程序,其中同步申報的注冊申請56件,占比43.08%,具有明顯臨床價值的新藥22件,占比19.92%;按照現行《藥品注冊管理辦法》發布后納入范圍,89件注冊申請已納入優先審評審批程序,其中符合附條件批準的藥品31件,占比34.83%,符合兒童生理特征的兒童用藥品新品種、劑型和規格9件,占比10.11%。2021年通過優先審評建議批準的注冊申請量詳見表17。
4.特別審批程序
2021年審結81件納入特別審批程序的注冊申請(新冠病毒疫苗和治療藥物),其中,批準新冠病毒疫苗IND 12件,建議批準新冠病毒疫苗NDA 5件(均為附條件批準上市),分別為4件新型冠狀病毒滅活疫苗(Vero細胞)、1件重組新型冠狀病毒疫苗(5型腺病毒載體);批準新冠病毒治療藥物IND 15件,分別為小分子抗病毒藥物4件,中和抗體9件,其他類藥物2件;建議批準新冠病毒治療藥物NDA 5件,分別為清肺排毒顆粒、化濕敗毒顆粒、宣肺敗毒顆粒、新冠病毒中和抗體聯合治療藥物安巴韋單抗注射液(BRII-196)及羅米司韋單抗注射液(BRII-198);批準涉及新冠病毒相關補充申請44件。
(二)與申請人溝通交流情況
藥審中心不斷調整溝通交流和咨詢方式,以適應疫情防控常態化和申請人逐年增長的溝通交流需求。目前,藥審中心與申請人溝通交流和咨詢的方式主要有:召開溝通交流會議、藥審中心網站(申請人之窗)一般性技術問題咨詢、電話咨詢、郵件咨詢等。
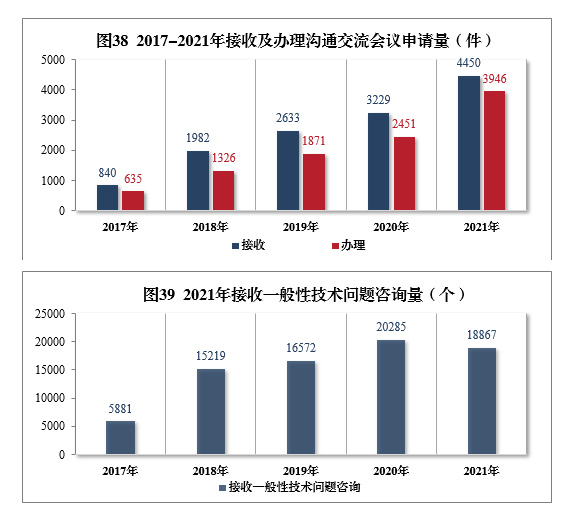
2021年接收溝通交流會議申請4450件,同比增長37.81%,辦理溝通交流會議申請3946件,同比增長61.00%。接收一般性技術問題咨詢18867個,辦理一般性技術問題咨詢18423個;辦理電話咨詢一萬余次,8個聯系郵箱24咨詢近萬次,2017-2021年接收及辦理溝通交流會議申請量詳見圖38,2021年接收一般性技術問題咨詢量詳見圖39。
2.溝通交流會議辦理情況
2021年接收溝通交流會議申請4450件。經綜合評估,符合溝通交流會議召開條件的,及時與申請人取得聯系,商議會議細節;無需召開溝通交流會議的,以書面形式盡快回復申請人。2021年辦理溝通交流會議申請3946件,在藥物研發關鍵階段召開的Ⅱ類會議69.23%,其中新藥臨床前(Pre-IND)申請32.84%,新藥生產前(Pre-NDA)申請11.05%。2021年溝通交流會議申請接收及辦理量詳見表18。
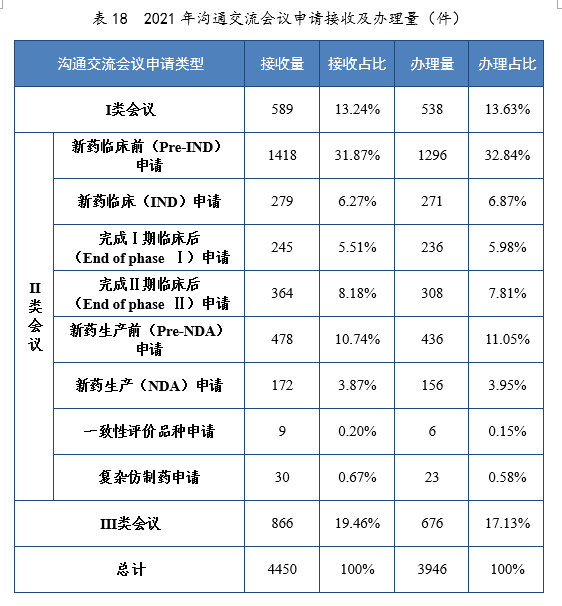
2021年召開溝通交流會議(面對面會議、視頻會議和電話會議)425次,同比增長58.58%。Ⅱ類會議占比70.35%,其中新藥臨床前(Pre-IND)申請占比21.65%;新藥生產前(Pre-IND)申請占比18.12%。2018-2021年溝通交流會議召開量詳見表19。
第四章 藥品注冊申請存在的主要問題及分析
2021年,藥品注冊申請經技術審評后審評結論為不批準/建議不批準的注冊申請542件,其中,359件屬于因申請人未能在規定時限內補充資料的情形,占全年不批準/建議不批準總量的66.3%,包括中藥9件、化學藥349件、生物制品1件;183件注冊申請主要存在申報資料無法證明申請注冊藥品的安全性、有效性或質量可控性等缺陷問題,包括中藥14件、化學藥126件、生物制品43件。
(一)主要問題
1.研發立題方面
這方面問題主要存在于早期開發品種(IND階段)和某些仿制藥及補充申請的開發立項階段。具體包括:藥物研發的臨床定位不清,適應癥選擇不合理;劑型或給藥途徑選擇不合理;已有研究數據提示藥效作用不明顯,作用靶點和機制不清晰,成藥性風險高;聯合用藥違背臨床診療和用藥原則,或缺乏有效性和安全性研究數據支持;已有的研究數據不支持已上市品種的改良開發;仿制藥研發的參比制劑因安全有效性問題已撤市;補充申請變更事項缺乏科學性和合理性。
2.有效性方面
這方面問題在上市注冊申請中比較常見。具體包括:已有的臨床研究數據尚無法證明品種的有效性;已開展的臨床研究存在試驗方案或者研究質量控制問題,無法評價受試品種的有效性;仿制藥人體生物等效性試驗結果表明和參比制劑不等效;化學藥注冊分類第3類的上市注冊申請缺乏境內有效性臨床數據。
3.安全性方面
藥物安全性方面問題存在于藥物開發的各個階段。具體包括:早期(IND階段)研究結果提示毒性明顯或者安全窗過于狹窄,難以進入臨床開發或提示應用于臨床可能綜合獲益非常有限;臨床前安全性研究方法或研究質量控制問題,或者研究數據不充分,不足以支持后續臨床開發;已有的臨床研究數據顯示存在嚴重不良反應,臨床應用獲益和風險比值不合理;化學藥注冊分類第3類的上市注冊申請缺乏境內安全性臨床數據。
4.質量可控性方面
這方面問題常見于仿制藥的開發。具體包括:藥學研究存在嚴重缺陷,無法證明產品的質量可控性;申報資料無法證明仿制藥與參比制劑質量的一致性;各開發階段的研究受試樣品不一致;樣品穩定性研究結果、原料藥起始物料選擇等不符合仿制藥上市技術要求;仿制藥未按規定使用具有合法來源的原料藥;樣品復核檢驗不符合規定或檢驗方法存在嚴重缺陷。
5.合規性方面
這方面問題常見于經注冊核查和注冊檢驗的注冊申請。具體包括:注冊核查中發現研究數據存在真實性問題;注冊核查中發現其他影響產品質量的重大缺陷;注冊核查抽樣檢驗不合格。
6.其他方面
具體包括:未按溝通交流時監管方提出的要求和標準提供研究數據或補充完善研究項目;審評中發現研究內容缺項,無法支持注冊申請事項;藥品說明書修訂補充申請不符合說明書撰寫要求和管理規范;用于支持變更補充申請的文獻依據或者研究數據支持不足。
(二)與往年情況的比較
總體上看,2021年注冊申請存在的主要問題,在分類、具體表現等方面與往年具有較大的相似性。但也出現了一些變化,主要包括:
1.出現的新問題
申請人未按在臨床試驗申請前溝通交流時監管方提出的補充資料要求提交研究資料,導致審評過程中發現IND研究內容缺項。根據現行《藥品注冊管理辦法》第八十八條規定,申請人在藥物臨床試驗申請的審評期間不得補充新的技術資料,致使審評不通過。
上述情況主要由于申請人未注意依據現行《藥品注冊管理辦法》在審評期間不得補充新的技術資料,在提交注冊申請資料時忽視了溝通交流中已明確的應提交的研究資料。此類情形是過往導致無法獲批的原因中很少見到的。
2.基于某些問題而不批準的品種數量發生變化
一是2021年沒有出現因未進行溝通交流而不批準的注冊申請;二是因缺乏境內有效性、安全性臨床數據而未獲批準的化學藥注冊分類第3類上市注冊申請數量較往年明顯增加;三是因合規性問題而未獲批準的注冊申請數量較往年有減少趨勢;四是開發立題合理性問題未獲批準的注冊申請數量增加趨勢明顯。
上述情況和注冊申請過程中溝通交流管理要求,以及現行《藥品注冊管理辦法》實施后化學藥注冊分類第3類上市注冊申請審評結論管理要求的調整有關。
(三)啟示和建議
對近期注冊申請存在的主要問題進行梳理分析,可以從中得到啟示,并為參與藥物研發、注冊、監管的各方提供參考建議。
1.充分重視藥物開發立題依據
藥物開發應立足于臨床需求,尤其應重視解決未被滿足的臨床需求問題;應以臨床價值為導向,充分重視同類創新藥開發的優勢問題,避免群體化、低水平、重復性創新;應充分評估改良型新藥的臨床價值和優勢;變更補充申請應遵循必要性與合理性原則等。
2.利用好溝通交流機制
在已有的溝通交流機制下,申請人除了在藥物開發過程的各關鍵節點提出溝通交流申請,還可以加強在研發其他環節和審評審批過程中的溝通交流;溝通交流應基于問題,解決問題,就關注的問題達成共識,消除信息不對等,不宜將溝通交流和行政審批程序等同起來;對于溝通交流達成的共識,各方應予以充分遵循。
3.加強創新藥物開發的前期基礎研究
某些新機制、新靶點宜做充分的成藥性評估,開展盡可能多的概念驗證研究,以降低后續開發風險,以免造成研究資源浪費;創新藥商業開發策略應建立在科學性基礎上,重視成藥性證據鏈的完整性;應遵循藥物開發的科學邏輯,循序漸進,盡量減少非科學因素對開發進程的干擾。
第五章 重點治療領域品種
新冠病毒疫苗和新冠肺炎治療藥物:
1-2.新型冠狀病毒滅活疫苗(Vero細胞)(北京科興中維生物技術有限公司)、新型冠狀病毒滅活疫苗(Vero細胞)(國藥集團中國生物武漢生物制品研究所有限責任公司),適用于預防新型冠狀病毒感染所致的疾病(COVID-19)。
3.重組新型冠狀病毒疫苗(5型腺病毒載體),為首家獲批的國產腺病毒載體新冠病毒疫苗,適用于預防由新型冠狀病毒感染引起的疾病(COVID-19)。
4-6.清肺排毒顆粒、化濕敗毒顆粒、宣肺敗毒顆粒,即“三方”品種,為《新型冠狀病毒肺炎診療方案(試行第九版)》推薦藥物,清肺排毒顆粒用于感受寒濕疫毒所致的疫病,化濕敗毒顆粒用于濕毒侵肺所致的疫病,宣肺敗毒顆粒用于濕毒郁肺所致的疫病。“三方”品種均來源于古代經典名方,是新冠肺炎疫情暴發以來,在武漢抗疫臨床一線眾多院士專家篩選出有效方藥清肺排毒湯、化濕敗毒方、宣肺敗毒方的成果轉化,也是《國家藥監局關于發布〈中藥注冊分類及申報資料要求〉的通告》(2020年第68號)后首次按照“中藥注冊分類 3.2類 其他來源于古代經典名方的中藥復方制劑”審評審批的品種。“三方”品種的獲批上市為新冠肺炎治療提供了更多選擇,充分發揮了中醫藥在疫情防控中的作用。
7-8.安巴韋單抗注射液(BRII-196)、羅米司韋單抗注射液(BRII-198),為我國首家獲批擁有自主知識產權新冠病毒中和抗體聯合治療藥物,上述兩個藥品可治療新型冠狀病毒肺炎(COVID-19),聯合用于治療輕型和普通型且伴有進展為重型(包括住院或死亡)高風險因素的成人和青少年(12—17歲,體重≥40kg)新型冠狀病毒感染(COVID-19)患者,其中,青少年(12—17歲,體重≥40kg)適應癥人群為附條件批準,其獲批上市為新冠肺炎治療提供了更多選擇。
中藥新藥:
9.益氣通竅丸,具有益氣固表,散風通竅的功效,適用于治療對季節性過敏性鼻炎中醫辨證屬肺脾氣虛證。本品為黃芪、防風等14種藥味組成的原6類中藥新藥復方制劑,在中醫臨床經驗方基礎上進行研制,開展了隨機、雙盲、安慰劑平行對照、多中心臨床試驗,其獲批上市為季節性過敏性鼻炎患者提供了一種新的治療選擇。
10.益腎養心安神片,功能主治為益腎、養心、安神,適用于治療失眠癥中醫辨證屬心血虧虛、腎精不足證,癥見失眠、多夢、心悸、神疲乏力、健忘、頭暈、腰膝酸軟等,舌淡紅苔薄白,脈沉細或細弱。本品為炒酸棗仁、制何首烏等10種藥味組成的原6類中藥新藥復方制劑,在中醫臨床經驗方基礎上進行研制,開展了隨機、雙盲、安慰劑平行對照、多中心臨床試驗,其獲批上市為失眠癥患者提供了一種新的治療選擇。
11.銀翹清熱片,功能主治為辛涼解表,清熱解毒,適用于治療外感風熱型普通感冒,癥見發熱、咽痛、惡風、鼻塞、流涕、頭痛、全身酸痛、汗出、咳嗽、口干,舌紅、脈數。本品為金銀花、葛根等9種藥味組成的1.1類中藥創新藥,在中醫臨床經驗方基礎上進行研制,開展了多中心、隨機、雙盲、安慰劑/陽性藥平行對照臨床試驗,其獲批上市為外感風熱型普通感冒患者提供了一種新的治療選擇。
12.玄七健骨片,具有活血舒筋,通脈止痛,補腎健骨的功效,適用于治療輕中度膝骨關節炎中醫辨證屬筋脈瘀滯證的癥狀改善。本品為延胡索、全蝎等11種藥味組成的1.1類中藥創新藥,基于中醫臨床經驗方基礎上進行研制,通過開展隨機、雙盲、安慰劑平行對照、多中心臨床試驗,獲得安全性、有效性證據,其獲批上市將為患者提供一種新的治療選擇。
13.芪蛭益腎膠囊,具有益氣養陰,化瘀通絡的功效,適用于治療早期糖尿病腎病氣陰兩虛證。本品為黃芪、地黃等10種藥味組成的1.1類中藥創新藥,基于中醫臨床經驗方基礎上進行研制,通過開展隨機、雙盲、安慰劑平行對照、多中心臨床試驗,獲得安全性、有效性證據,其獲批上市將為患者提供新的治療選擇。
14.坤心寧顆粒,具有溫陽養陰,益腎平肝的功效,適用于治療女性更年期綜合征中醫辨證屬腎陰陽兩虛證。本品為地黃、石決明等7種藥味組成的1.1類中藥創新藥,基于中醫臨床經驗方基礎上進行研制,通過開展隨機、雙盲、安慰劑平行對照、多中心臨床試驗,獲得安全性、有效性證據,其獲批上市將為患者提供新的治療選擇。
15.虎貞清風膠囊,具有清熱利濕,化瘀利濁,滋補肝腎的功效,適用于治療輕中度急性痛風性關節炎中醫辨證屬濕熱蘊結證。本品為虎杖、車前草等4種藥味組成的1.1類中藥創新藥,在中醫臨床經驗方基礎上進行研制,開展了隨機、雙盲、安慰劑平行對照、多中心臨床試驗,獲得安全性、有效性證據,其獲批上市將為患者提供新的治療選擇。
16.解郁除煩膠囊,具有解郁化痰、清熱除煩的功效,適用于治療輕、中度抑郁癥中醫辨證屬氣郁痰阻、郁火內擾證。本品種為梔子、姜厚樸等8種藥味組成的1.1類中藥創新藥,在中醫臨床經驗方基礎上進行研制,處方根據中醫經典著作《金匱要略》記載的半夏厚樸湯和《傷寒論》記載的梔子厚樸湯化裁而來,開展了隨機、雙盲、陽性對照藥(化學藥品)、安慰劑平行對照、多中心臨床試驗,獲得安全性、有效性證據,其獲批上市將為患者提供新的治療選擇。
17.七蕊胃舒膠囊,具有活血化瘀,燥濕止痛的功效,適用于治療輕中度慢性非萎縮性胃炎伴糜爛濕熱瘀阻證所致的胃脘疼痛。本品為三七、枯礬等4種藥味組成的1.1類中藥創新藥,在醫療機構制劑基礎上進行研制,開展了隨機、雙盲、陽性藥平行對照、多中心臨床試驗,其獲批上市為慢性胃炎患者提供了新的治療選擇。
18.淫羊藿素軟膠囊,適用于治療不適合或患者拒絕接受標準治療、且既往未接受過全身系統性治療的、不可切除的肝細胞癌,患者外周血復合標志物滿足以下檢測指標的至少兩項:AFP≥400 ng/mL;TNF-α<2.5pg/mL;IFN-γ≥7.0pg/mL。本品為從中藥材淫羊藿中提取制成的1.2類中藥創新藥,其獲批上市為肝細胞癌患者提供了新的治療選擇。
罕見病藥物:
19.布羅索尤單抗注射液,適用于治療成人和1歲以上兒童患者的X連鎖低磷血癥(XLH)。X連鎖低磷血癥屬罕見病,目前尚無有效治療藥物。本品種屬臨床急需境外新藥名單品種,為以成纖維細胞生長因子23(FGF23)抗原為靶點的一種重組全人源IgG1單克隆抗體,可結合并抑制FGF23活性從而使血清磷水平增加,其獲批上市為患者提供了新的治療選擇。
20.醋酸艾替班特注射液,適用于治療成人、青少年和≥2歲兒童的遺傳性血管性水腫急性發作。遺傳性血管性水腫屬罕見病,近半數患者會出現上呼吸道黏膜水腫,引發窒息進而危及生命,已被納入國家衛生健康委員會等五部門聯合公布的《第一批罕見病目錄》。本品種屬臨床急需境外新藥名單品種,為緩激肽B2受體的競爭性拮抗劑,其獲批上市可為我國遺傳性血管性水腫患者的預防發作提供安全有效的藥物。
21.注射用艾諾凝血素α,適用于成人和兒童B型血友病(先天性IX因子缺乏)患者的以下治療:按需治療以及控制出血事件;圍手術期的出血管理;常規預防,以降低出血事件的發生頻率。血友病B屬遺傳性、出血性罕見病,目前國內尚無長效重組人凝血因子Ⅸ進口或上市。本品種屬臨床急需境外新藥名單品種,為首個在國內申報進口的長效重組人凝血因子IX產品,其獲批上市為患者提供了新的治療選擇。
22.注射用司妥昔單抗,適用于治療人體免疫缺陷病毒(HIV)陰性和人皰疹病毒8型(HHV-8)陰性的多中心卡斯特曼病(MCD)成人患者。MCD是一種以淋巴組織生長為特征的罕見病,多數患者出現多器官損害且預后差,部分患者會轉化為惡性淋巴瘤,已被納入國家衛生健康委員會等五部門聯合公布的《第一批罕見病目錄》。本品種屬臨床急需境外新藥名單品種,其獲批上市為患者提供了治療選擇。
23.奧法妥木單抗注射液,適用于治療成人復發型多發性硬化(RMS),包括臨床孤立綜合征、復發緩解型多發性硬化和活動性繼發進展型多發性硬化。多發性硬化(MS)是免疫介導的慢性中樞神經系統疾病,已被納入國家衛生健康委員會等五部門聯合公布的《第一批罕見病目錄》。本品為抗人CD20的全人源免疫球蛋白G1單克隆抗體,其獲批上市為患者提供了治療選擇。
兒童用藥:
24.利司撲蘭口服溶液用散,適用于治療2月齡及以上患者的脊髓性肌萎縮癥(SMA)。SAM是由于運動神經元存活基因1(SMN1)突變導致SMN蛋白功能缺陷所致的遺傳性神經肌肉病,是造成嬰幼兒死亡的常染色體隱性遺傳疾病之一,已被納入國家衛生健康委員會等五部門聯合公布的《第一批罕見病目錄》。本品種為治療兒童罕見病的1類創新藥,可直接靶向疾病的潛在分子缺陷,增加中樞組織和外周組織的功能性SMN蛋白的產生,其獲批上市可為SMA患者提供新的治療選擇。
25.達妥昔單抗β注射液,適用于治療≥12月齡的高危神經母細胞瘤和伴或不伴有殘留病灶的復發性或難治性神經母細胞瘤的兒童患者。神經母細胞瘤為兒童常見的惡性腫瘤之一,尚無免疫治療產品獲批上市。本品種屬臨床急需境外新藥名單品種,其獲批上市可豐富兒童患者的治療選擇。
26.順鉑注射液,此前已批準適用于小細胞與非小細胞肺癌、非精原細胞性生殖細胞癌、晚期難治性卵巢癌、晚期難治性膀胱癌、難治性頭頸鱗狀細胞癌、胃癌、食管癌的姑息治療,此次新增批準了兒童用法用量,其獲批上市保障了兒童臨床合理用藥。
27.鹽酸氨溴索噴霧劑,適用于治療2-6歲兒童的痰液粘稠及排痰困難。本品種為適合兒童使用劑型的改良型新藥,相對于口服制劑,可以避免遺撒和嘔吐,對于年齡小且不配合服藥的兒童而言,具有更好的順應性,其獲批上市可豐富兒童患者的治療選擇。
28.鹽酸頭孢卡品酯顆粒,適用于兒童對頭孢卡品敏感的菌所致的下列感染:皮膚軟組織感染、淋巴管和淋巴節炎、慢性膿皮病;咽炎、喉炎、扁桃體炎(包括扁桃體周炎,扁桃體周膿腫)、急性支氣管炎、肺炎;膀胱炎、腎盂腎炎;中耳炎、鼻竇炎;猩紅熱。本品種為第三代口服頭孢菌素類抗菌藥物,劑型具有較高的用藥依從性,適合兒童尤其是嬰幼兒使用,其獲批上市可為兒童患者提供一種有效的治療選擇。
公共衛生用藥:
29.四價流感病毒裂解疫苗,適用于3歲及以上人群預防疫苗相關型別的流感病毒引起的流行性感冒。本品種為使用世界衛生組織推薦的甲型(H1N1和H3N2)和乙型(B/Victoria和B/Yamagata)流行性感冒病毒株制成的裂解疫苗,國內既往使用的流感疫苗以三價流感病毒裂解疫苗為主,本品種在此基礎上增加了一種乙型流感抗原,以增加對乙型流感的抗體保護率和陽轉率,其獲批上市有助于進一步緩解四價流感疫苗供不應求的矛盾。
30.ACYW135群腦膜炎球菌多糖結合疫苗(CRM197載體),適用于預防A群、C群、Y群和W135群腦膜炎奈瑟球菌引起的流行性腦脊髓膜炎。本品種為國內首個批準上市的四價腦膜炎多糖結合疫苗,其獲批上市可填補國內2歲以下兒童無Y群、W135群腦膜炎多糖結合疫苗可用的空白。
31.凍干人用狂犬病疫苗(Vero細胞),適用于預防狂犬病。目前國內僅兩家企業疫苗獲批四劑免疫程序,其余均為五劑免疫程序,本品種同時申報五劑免疫程序和2-1-1四劑免疫程序,其獲批上市可進一步緩解狂犬病疫苗市場短缺現象。
抗腫瘤藥物:
32.甲磺酸伏美替尼片,適用于既往經EGFR酪氨酸激酶抑制劑治療時或治療后出現疾病進展,并且經檢測確認存在EGFR T790M突變陽性的局部晚期或轉移性非小細胞性肺癌(NSCLC)成人患者的治療。本品種是我國自主研發并擁有自主知識產權的1類創新藥,為第三代表皮生長因子受體(EGFR)激酶抑制劑,其獲批上市為患者提供了新的治療選擇。
33.普拉替尼膠囊,適用于既往接受過含鉑化療的轉染重排(RET)基因融合陽性的局部晚期或轉移性非小細胞性肺癌(NSCLC)成人患者的治療。本品為受體酪氨酸激酶RET(Rearranged during Transfection)抑制劑的1類創新藥,可選擇性抑制RET激酶活性,可劑量依賴性抑制RET及其下游分子磷酸化,有效抑制表達RET(野生型和多種突變型)的細胞增殖,其獲批上市為患者提供了新的治療選擇。
34.賽沃替尼片,適用于治療含鉑化療后疾病進展或不耐受標準含鉑化療的、具有間質-上皮轉化因子(MET)外顯子14跳變的局部晚期或轉移性非小細胞肺癌成人患者。本品種是我國擁有自主知識產權的1類創新藥,為我國首個獲批的特異性靶向MET激酶的小分子抑制劑,可選擇性抑制MET激酶的磷酸化,對MET 14號外顯子跳變的腫瘤細胞增殖有明顯的抑制作用,其獲批上市為患者提供了新的治療選擇。
35.舒格利單抗注射液,適用于聯合培美曲塞和卡鉑用于表皮生長因子受體(EGFR)基因突變陰性和間變性淋巴瘤激酶(ALK)陰性的轉移性非鱗狀非小細胞肺癌患者的一線治療,以及聯合紫杉醇和卡鉑用于轉移性鱗狀非小細胞肺癌患者的一線治療。本品為重組抗PD-L1全人源單克隆抗體,可阻斷PD-L1與T細胞上PD-1和免疫細胞上CD80間的相互作用,通過消除PD-L1對細胞毒性T細胞的免疫抑制作用,發揮抗腫瘤作用,其獲批上市為患者提供了新的治療選擇。
36.優替德隆注射液,適用于聯合卡培他濱,治療既往接受過至少一種化療方案的復發或轉移性乳腺癌患者。本品種是我國自主研發并擁有自主知識產權的1類創新藥,為埃坡霉素類衍生物,可促進微管蛋白聚合并穩定微管結構,誘導細胞凋亡,其獲批上市為患者提供了新的治療選擇。
37.羥乙磺酸達爾西利片,適用于聯合氟維司群,治療既往接受內分泌治療后出現疾病進展的激素受體陽性、人表皮生長因子受體2陰性的復發或轉移性乳腺癌患者。本品種是一種周期蛋白依賴性激酶4和6(CDK4和CDK6)抑制劑的1類創新藥,可降低CDK4和CDK6信號通路下游的視網膜母細胞瘤蛋白磷酸化水平,并誘導細胞G1期阻滯,從而抑制腫瘤細胞的增殖。其獲批上市為患者提供了新的治療選擇。
38.帕米帕利膠囊,適用于既往經過二線及以上化療的伴有胚系BRCA(gBRCA)突變的復發性晚期卵巢癌、輸卵管癌或原發性腹膜癌患者的治療。本品種為PARP-1和PARP-2的強效、選擇性抑制劑1類創新藥,通過抑制腫瘤細胞DNA單鏈損傷的修復和同源重組修復缺陷,對腫瘤細胞起到合成致死的作用,尤其對攜帶BRCA基因突變的DNA修復缺陷型腫瘤細胞敏感度高。其獲批上市為患者提供了新的治療選擇。
39.甲苯磺酸多納非尼片,適用于既往未接受過全身系統性治療的不可切除肝細胞癌患者。本品種是我國自主研發并擁有自主知識產權的1類創新藥,為多激酶抑制劑類小分子抗腫瘤藥物,其獲批上市為患者提供了一種新的治療選擇。
40.注射用維迪西妥單抗,適用于至少接受過2種系統化療的人表皮生長因子受體-2過表達局部晚期或轉移性胃癌(包括胃食管結合部腺癌)患者的治療。本品種為我國自主研發的創新抗體偶聯藥物(ADC),包含人表皮生長因子受體-2(HER2)抗體部分、連接子和細胞毒藥物單甲基澳瑞他汀E(MMAE),其獲批上市為患者提供了新的治療選擇。
41.阿基侖賽注射液,適用于治療既往接受二線或以上系統性治療后復發或難治性大B細胞淋巴瘤成人患者(包括彌漫性大B細胞淋巴瘤非特指型、原發縱膈大B細胞淋巴瘤、高級別B細胞淋巴瘤和濾泡淋巴瘤轉化的彌漫性大B細胞淋巴瘤)。本品種為我國首個批準上市的細胞治療類產品,是一種自體免疫細胞注射劑,由攜帶CD19 CAR基因的逆轉錄病毒載體進行基因修飾的自體靶向人CD19嵌合抗原受體T細胞(CAR-T)制備,其獲批上市為患者提供了新的治療選擇。
42.瑞基奧侖賽注射液,適用于治療經過二線或以上系統性治療后成人患者的復發或難治性大B細胞淋巴瘤。本品種是我國首款自主研發的以及中國第二款獲批上市的細胞治療類產品,為靶向CD19的自體CAR-T細胞免疫治療產品,其獲批上市為患者提供了新的治療選擇。
43.奧雷巴替尼片,適用于治療任何酪氨酸激酶抑制劑耐藥,并采用經充分驗證的檢測方法診斷為伴有T315I突變的慢性髓細胞白血病慢性期或加速期的成年患者。本品種為我國自主研發并擁有自主知識產權的1類創新藥,是小分子蛋白酪氨酸激酶抑制劑,可有效抑制Bcr-Abl酪氨酸激酶野生型及多種突變型的活性,可抑制Bcr-Abl酪氨酸激酶及下游蛋白STAT5和Crkl的磷酸化,阻斷下游通路活化,誘導Bcr-Abl陽性、Bcr-Abl T315I突變型細胞株的細胞周期阻滯和調亡,是國內首個獲批伴有T315I突變的慢性髓細胞白血病適應癥的藥品,其獲批上市為因T315I突變導致耐藥的患者提供了有效的治療手段。
44.恩沃利單抗注射液,適用于不可切除或轉移性微衛星高度不穩定(MSI-H)或錯配修復基因缺陷型(dMMR)的成人晚期實體瘤患者的治療,包括既往經過氟尿嘧啶類、奧沙利鉑和伊立替康治療后出現疾病進展的晚期結直腸癌患者以及既往治療后出現疾病進展且無滿意替代治療方案的其他晚期實體瘤患者。本品種為我國自主研發的創新PD-L1抗體藥物,為重組人源化PD-L1單域抗體Fc融合蛋白注射液,可結合人PD-L1蛋白,并阻斷其與受體PD-1的相互作用,解除腫瘤通過PD-1/PD-L1途徑對T細胞的抑制作用,調動免疫系統的抗腫瘤活性殺傷腫瘤,其獲批上市為患者提供了新的治療選擇。
抗感染藥物:
45.阿茲夫定片,與核苷逆轉錄酶抑制劑及非核苷逆轉錄酶抑制劑聯用,適用于治療高病毒載量的成年HIV-1感染患者。本品種是新型核苷類逆轉錄酶和輔助蛋白Vif抑制劑的1類創新藥,也是首個上述雙靶點抗HIV-1藥物,能夠選擇性進入HIV-1靶細胞外周血單核細胞中的CD4細胞或CD14細胞,發揮抑制病毒復制功能。其獲批上市為HIV-1感染者提供了新的治療選擇。
46.艾諾韋林片,適用于與核苷類抗逆轉錄病毒藥物聯合使用,治療成人HIV-1感染初治患者。本品種為HIV-1新型非核苷類逆轉錄酶抑制劑的1類創新藥,通過非競爭性結合HIV-1逆轉錄酶抑制HIV-1的復制,其獲批上市為HIV-1感染患者提供了新的治療選擇。
47.艾米替諾福韋片,適用于治療慢性乙型肝炎成人患者。本品種是我國自主研發并擁有自主知識產權的1類創新藥,為核苷類逆轉錄酶抑制劑,其獲批上市為慢性乙型肝炎患者提供了新的治療選擇。
48-49.甲苯磺酸奧馬環素片、注射用甲苯磺酸奧馬環素,適用于治療社區獲得性細菌性肺炎(CABP)、急性細菌性皮膚和皮膚結構感染(ABSSSI)。甲苯磺酸奧馬環素為新型四環素類抗菌藥,具有廣譜抗菌活性,以及口服和靜脈輸注兩種劑型,其獲批上市豐富了患者的治療選擇,提高了藥品可及性。
50.康替唑胺片,適用于治療對康替唑胺敏感的金黃色葡萄球菌(甲氧西林敏感和耐藥的菌株)、化膿性鏈球菌或無乳鏈球菌引起的復雜性皮膚和軟組織感染。本品種是我國自主研發并擁有自主知識產權的1類創新藥,為全合成的新型噁唑烷酮類抗菌藥,其獲批上市為患者提供了新的治療選擇。
51.蘋果酸奈諾沙星氯化鈉注射液,適用于治療對奈諾沙星敏感的肺炎鏈球菌、金黃色葡萄球菌、流感嗜血桿菌、副流感嗜血桿菌、卡他莫拉菌、肺炎克雷伯菌、銅綠假單胞菌以及肺炎支原體、肺炎衣原體和嗜肺軍團菌所致的成人(≥18歲)社區獲得性肺炎。本品種為無氟喹諾酮類抗菌藥,與含氟喹諾酮類抗菌藥具有不同的作用位點,其獲批上市可為患者提供新的治療選擇。
52.注射用磷酸左奧硝唑酯二鈉,適用于治療腸道和肝臟嚴重的阿米巴病、奧硝唑敏感厭氧菌引起的手術后感染和預防外科手術導致的敏感厭氧菌感染。本品種屬于最新一代硝基咪唑類抗感染藥,其獲批上市可為厭氧菌感染的治療和預防提供新的治療選擇。
內分泌系統藥物:
53.西格列他鈉片,適用于配合飲食控制和運動,改善成人2型糖尿病患者的血糖控制。本品種是我國自主研發并擁有自主知識產權的1類創新藥,為過氧化物酶體增殖物激活受體(PPAR)全激動劑,能同時激活PPAR三個亞型受體(α、γ和δ),并誘導下游與胰島素敏感性、脂肪酸氧化、能量轉化和脂質轉運等功能相關的靶基因表達,抑制與胰島素抵抗相關的PPARγ受體磷酸化,其獲批上市為患者提供了新的治療選擇。
54.脯氨酸恒格列凈片,適用于改善成人2型糖尿病患者的血糖控制。本品種是我國自主研發并擁有自主知識產權的1類創新藥,為鈉-葡萄糖協同轉運蛋白2(SGLT2)抑制劑,通過抑制SGLT2,減少腎小管濾過的葡萄糖的重吸收,降低葡萄糖的腎閾值,從而增加尿糖排泄。其獲批上市為患者提供新的治療選擇。
循環系統藥物:
55.海博麥布片,適用于作為飲食控制以外的輔助治療,可單獨或與HMG-CoA還原酶抑制劑(他汀類)聯合用于治療原發性(雜合子家族性或非家族性)高膽固醇血癥,可降低總膽固醇、低密度脂蛋白膽固醇、載脂蛋白B水平。本品種為我國自主研發并擁有自主知識產權的1類創新藥,可抑制甾醇載體Niemann-Pick C1-like1(NPC1L1)依賴的膽固醇吸收,從而減少小腸中膽固醇向肝臟轉運,降低血膽固醇水平,降低肝臟膽固醇貯量,其獲批上市為原發性高膽固醇血癥患者提供了新的治療選擇。
血液系統藥物:
56.海曲泊帕乙醇胺片,適用于因血小板減少和臨床條件導致出血風險增加的既往對糖皮質激素、免疫球蛋白等治療反應不佳的慢性原發免疫性血小板減少癥成人患者,以及對免疫抑制治療療效不佳的重型再生障礙性貧血(SAA)成人患者。本品種是我國自主研發并擁有自主知識產權的1類創新藥,為小分子人血小板生成素受體激動劑,其獲批上市為患者提供了新的治療選擇。
風濕性疾病及免疫藥物:
57.注射用泰它西普,適用于與常規治療聯合用于在常規治療基礎上仍具有高疾病活動的活動性、自身抗體陽性的系統性紅斑狼瘡(SLE)成年患者。本品種為我國自主研發的創新治療用生物制品,可將B淋巴細胞刺激因子(BLyS)受體跨膜蛋白活化物(TACI)的胞外特定的可溶性部分,與人免疫球蛋白G1(IgG1)的可結晶片段(Fc)構建成的融合蛋白,由于TACI受體對BLyS和增殖誘導配體(APRIL)具有很高的親和力,本品種可以阻止BLyS和APRIL與它們的細胞膜受體、B細胞成熟抗原、B細胞活化分子受體之間的相互作用,從而達到抑制BLyS和APRIL的生物學活性的作用,其獲批上市為患者提供了新的治療選擇。
皮膚五官藥物:
58.阿普米司特片,適用于治療符合接受光療或系統治療指征的中度至重度斑塊狀銀屑病的成人患者。本品種屬臨床急需境外新藥名單品種,是磷酸二酯酶4(PDE4)小分子抑制劑,可以通過抑制PDE4促使細胞內環磷酸腺苷(cAMP)含量升高,從而增加抗炎細胞因子,并下調炎癥反應,其獲批上市可為患者提供一種給藥便利的新型替代治療選擇。
第六章 高效做好應急審評
2021年,新冠肺炎疫情全球大流行仍處于發展階段,病毒不斷變異進一步增加了疫情的不確定性,我國疫情防控“外防輸入、內防反彈”壓力持續增大,人民群眾對疫苗藥品的期待不斷增高,國際社會對我國疫苗藥品安全的關注度與日俱增。在這種形勢下,黨和國家對新冠病毒疫苗藥物審評審批工作不斷提出更高要求,國務院副總理孫春蘭、國務委員肖捷親赴藥審中心調研并召開座談會。藥審中心堅持人民至上、生命至上,尊重科學、遵循規律,以高效應對疫情形勢變化的工作機制和舉措,全力服務保障疫情防控工作大局,持續做好新冠病毒治療藥物、新冠病毒疫苗應急審評審批工作,交出了滿意答卷。
(一)加速推動新冠病毒治療藥物研發上市
藥審中心堅決有力落實孫春蘭副總理、肖捷國務委員調研座談會部署要求,嚴守新冠病毒治療藥物研發安全有效標準,加快重點藥物應急審評審批,為應對突發公共衛生事件和新冠重大疫情提供科技保障。
一是第一時間學習傳達調研座談會議精神,研究貫徹落實措施,梳理新冠病毒藥物應急審評工作進展情況,對重點品種按照“一藥一策一團隊”原則,逐個制定應急審評工作方案,建立工作機制,明確上市審評技術標準,確定上市審評工作節點,制定上市審評倒排時間表、路線圖,形成《新冠藥物上市審評工作方案》。
二是加強研審聯動、主動指導企業,持續跟進新冠病毒治療藥物研發進展,對于已進入Ⅲ期臨床試驗或已獲得初步臨床試驗數據提示臨床終點獲益的重點品種,依法依規做好新冠病毒藥物審評工作,加快推動新冠病毒藥物獲批上市。同時密切關注國際上新冠病毒治療藥物研發、審評審批情況,做好知識儲備,以便更好的指導進口藥及國產仿制藥研發及上市申報。
三是落實申請人主體責任,對于申請附條件批準上市的品種,督促申請人按照承諾按時完成相關研究并遞交相關資料,做好新冠病毒治療藥物全生命周期科學監管。
四是在中藥應急審評方面,藥審中心第一時間調集中藥技術審評骨干力量,形成新冠肺炎疫情中藥應急審評專項工作小組,深入了解新冠肺炎病理特征、演變規律、中醫證候和辨證施治的原則,緊跟抗疫一線中醫藥使用情況和研發動態,結合國家衛生健康委發布的《新型冠狀病毒肺炎診療方案》,不斷加深對中醫藥在新冠肺炎治療中獨特作用和臨床需要的認識。
五是加強對申請人的技術指導和注冊服務,隨研發隨提交,隨提交隨審評,大大縮短了審評時間,進一步優化了審評流程,累計完成84項立項申請的可行性評議工作,所有立項申請均在24小時內完成。在此基礎上,全天候接受相關品種申請人在研發和整理申報資料過程中遇到的問題并堅持做到隨到隨答。按照“邊審評、邊研究、邊總結”的工作模式,充分發揮以中醫藥院士和抗疫臨床一線專家為主的特別專家組的指導作用,完成“三方”抗疫成果轉化。
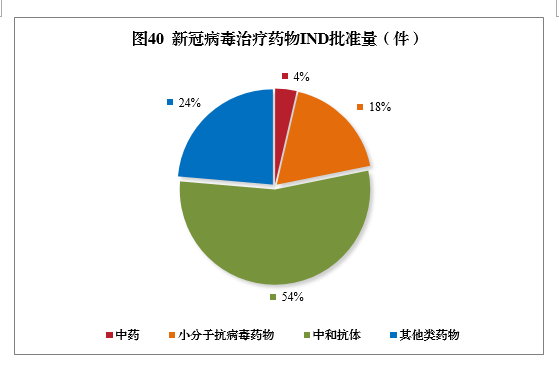
截至2021年底,累計批準55個品種新冠病毒治療藥物IND,包括中藥2個,小分子抗病毒藥物10個,中和抗體30個,其他類藥物13個。2021年,新冠病毒中和抗體聯合治療藥物(安巴韋單抗注射液、羅米司韋單抗注射液)、清肺排毒顆粒、化濕敗毒顆粒、宣肺敗毒顆粒已獲批上市。新冠病毒治療藥物臨床試驗申請獲批情況詳見圖40。
(二)堅持研審聯動,創新工作模式,高效完成新冠病毒疫苗應急審評工作
藥審中心深入貫徹落實黨中央、國務院和國家局部署,持續優化“早期介入、持續跟蹤、研審聯動、科學審評”全天候應急審評審批工作機制,積極履職擔當。
一是截至2021年底,加速推動4個新冠病毒疫苗附條件批準上市,5條技術路線的27個疫苗品種獲批開展臨床試驗,其中9個進入Ⅲ期臨床試驗,新冠病毒疫苗審評取得重大突破。
二是主動服務疫苗企業,提供全程指導,與WHO積極溝通,全力支持2款國產新冠病毒疫苗納入WHO緊急使用清單,取得歷史性突破,為全面疫情防控、為企業復工復產、推動我國經濟社會發展提供了重要保障,也為落實習近平總書記“疫苗作為全人類公共產品”的承諾提供了堅實支撐,展現了疫苗應急審評審批的“中國質量”和“大國擔當”,為全球攜手戰勝疫情注入了強大信心。
三是積極推進新冠病毒疫苗擴產保質保供相關工作,創新工作模式,深入江蘇、北京、安徽等地新冠病毒疫苗生產企業進行現場指導、現場辦公,研究解決技術問題,高效完成擴產能應急審評工作,全面提升我國疫苗年產能達數十億劑,擴大了疫苗的可及性和可負擔性,有效地保障了人民群眾的接種需求。
四是繼續強化服務指導,持續跟進各技術路線新冠病毒疫苗研發進展,尤其是重點跟進重組蛋白類、核酸類新冠病毒疫苗臨床試驗進展情況,依法依規做好新冠病毒疫苗審評工作,推動更多新冠病毒疫苗獲批上市,為抗擊疫情擴充“武器庫”,補充“彈藥”。
五是密切關注新冠病毒流行株的變化情況,指導督促企業開展相關研究,及時調整研發策略,鼓勵開展針對變異株新冠病毒疫苗研發并提供技術指導,為后續疫情防控提供支撐。
六是督促新冠病毒疫苗上市許可持有人,落實主體責任,完成附條件批準時要求的各項相關任務,持續深化對附條件上市產品安全性特征的認識。
七是積極參加WHO、國際藥品監管機構聯盟(ICMRA)等組織召開的視頻電話會議,共同探討研發與評價標準,推動我國新冠病毒疫苗研發注冊標準與國際接軌,為中國新冠病毒疫苗走向世界打下了堅實基礎,為助力全球抗疫貢獻了寶貴的中國藥監智慧、中國藥審力量。截至2021年底,藥審中心累計派員參加WHO相關會議71場,參加ICMRA相關會議49場。
在高效完成應急審評工作的同時,藥審中心及時梳理應急審評中好經驗好做法,完善現有審評工作流程,探索制定加快創新藥上市申請的工作機制和程序,加快新藥新疫苗上市,不斷滿足人民群眾的健康需求。
第七章 持續深化審評審批制度改革
(一)多措并舉滿足兒童用藥臨床急需、促進兒童用藥研發創新
“支持研發嚴格監管兒童藥”是國家局黨史學習教育“我為群眾辦實事”實踐活動“藥品監管惠企利民十大項目”之一。為切實解決人民群眾“急難愁盼”的用藥問題,藥審中心多措并舉,精準發力,謀劃解決兒童用藥研發重點、難點問題,鼓勵和促進兒童用藥的研發創新,不斷滿足臨床需求。
創新兒童用藥審評管理工作機制。藥審中心成立兒童用藥專項領導小組和工作小組,形成任務統一部署、力量統籌調配、工作一體推進的工作格局,有效提高了發現問題、解決問題的能力。
深入調研,協調各方共破兒童用藥難題。解決兒童用藥難的問題,需要監管部門、臨床機構和藥品生產企業同向發力。藥審中心多次前往國家兒童醫學中心和科研企業進行調研座談,以臨床需求為導向共同研究和解決兒童用藥研發、使用和審評中的技術問題,提升我國兒童用藥研發和科學監管水平。
落實兒童用藥優先審評審批政策,提高兒童用藥安全性和可及性。藥審中心堅持“高標準、嚴要求、強服務”的原則,借鑒新冠病毒治療藥物等應急審評審批經驗,在審評系統中設立“兒童用藥”特殊標識,優化審評資源配置,專人對接,加快兒童用藥上市速度。2021年共有24件適用于兒童的藥品上市許可申請通過優先審評審批程序獲批上市。
完善兒童用藥審評標準體系,指導科學研發。藥審中心按照“急用先行”的原則,結合臨床實際、借鑒國際經驗、集中專家智慧、大膽探索實踐,建立了包含真實世界數據支持等指導原則在內的兒童用藥研發審評證據體系。截至2021年底共發布了《兒童用藥(化學藥品)藥學開發指導原則(試行)》《真實世界研究支持兒童用藥物研發與審評的技術指導原則(試行)》《注意缺陷多動障礙(ADHD)藥物臨床試驗技術指導原則》等12項兒童用藥專項指導原則,完善了兒童用藥臨床試驗和安全性評價標準,為研發和審評提供了重要技術支持與審評依據,激發了企業研發活力,更好地指導了兒童用藥的科學研發。
開展已上市藥品說明書中兒童用藥信息規范化增補工作,保障兒童臨床科學用藥。藥審中心著力改善兒科臨床中普遍存在的超說明書使用現狀,破解“兒童吃藥靠掰,用量靠猜”的困局。會同國家兒童醫學中心及其醫聯體成員單位,設立“中國兒童說明書規范化項目”,充分利用兒童醫療機構數據資源,采用真實世界研究方法,篩選出建議修訂說明書的品種名單和具體修訂內容,現已公布兩批修訂說明書的品種名單。
加強兒童用藥的政策宣傳與培訓力度。藥審中心于2021年6月1日在網站開設了“兒童用藥專欄”,及時公布與兒童用藥相關的政策法規、指導原則、培訓資料、品種批準信息等內容,集中展示了我國兒童用藥審評工作,加強政策解讀和宣傳。人民日報刊發了《多舉措鼓勵兒童用藥研發生產——滿足用藥需求 保障用藥安全》,中國醫藥報社刊發了《全力破解兒童用藥短缺難題》。
(二)完善臨床試驗管理制度、提高藥物臨床研究質量
1.發布《中國新藥注冊臨床試驗現狀年度報告(2020年)》
為全面掌握中國新藥注冊臨床試驗現狀,及時對外公開臨床試驗進展信息,為新藥研發、資源配置和藥品審評審批提供參考,藥審中心根據藥物臨床試驗登記與信息公示平臺的新藥臨床試驗登記信息,首次對中國新藥注冊臨床試驗現狀進行全面匯總分析,發布了《中國新藥注冊臨床試驗現狀年度報告(2020年)》。
藥審中心將以中國新藥注冊臨床試驗登記數據為依托,聚焦監管創新,提高監管效能,在推動藥品監管能力現代化中加強與業界溝通交流,增加信息透明度,助推中國新藥臨床試驗高質量健康發展。
2.強化新冠病毒疫苗、治療藥物的臨床試驗進展和安全監管工作
藥審中心嚴格按照新冠病毒疫苗、治療藥物臨床試驗過程中監管的工作要求,調整優化安全性監管措施,實施高頻次的藥物警戒及安全風險監管工作,加強對重點品種的安全監測與風險處理。截至2021年底,獲準開展臨床試驗的82個新冠病毒疫苗、治療藥物均被納入臨床試驗安全風險管理的專用通道。
3.推動《藥物警戒質量管理規范》落地實施
《藥物警戒質量管理規范》自2021年12月1日起正式施行,藥審中心參與了該規范及其配套文件的制定以及規范的宣貫培訓和技術解讀工作,提高申請人對藥物警戒的主體責任意識,助推《藥物警戒質量管理規范》落地實施。
4.逐步完善臨床試驗期間藥物警戒及安全風險管理工作
藥審中心緊跟國際藥物警戒新動態,結合中國實際,不斷完善藥物警戒工作的新理論、新方法和新工具,積極構建藥物警戒學科發展的監管科學體系和工作平臺。一是優化安全信息審評程序,構建臨床試驗期間安全風險管理系統(CTRiMS),實現了安全信息檢測和風險處理的電子化管理,增加臨床試驗期間安全風險管理的協調性、有序性、規范性。二是升級符合E2B(R3)區域實施要求的藥物警戒接收系統,提升安全數據庫應用功能,推進ICH E2B(R3)和ICH E2A指導原則在我國的轉化實施。三是優化安全風險管理機制,組建安全信息監測小組,對安全信息進行監測、識別、分析與初步評估,形成風險處理意見。四是形成臨床試驗安全信息的三級風險處理方式,即臨床試驗風險管理告知信、臨床試驗風險控制通知書、暫停或終止臨床試驗通知書,持續強化藥物臨床試驗期間安全信息報告評估管理。
5.安全信息的風險識別能力穩步提高
2021年收到國內臨床期間可疑且非預期的嚴重不良反應(SUSAR)首次報告7197份,同比增長54.51%;收到研發期間年度安全性報告(DSUR)2568份,同比增長42.82%。臨床試驗登記平臺登記信息15075條(包括首次登記和信息更新登記),同比增長22.95%。發出臨床試驗風險管理告知信86份、臨床試驗風險控制通知書21份,暫停臨床試驗通知書1份,建議申辦者主動暫停臨床試驗5次。
新冠病毒疫苗和新冠病毒治療藥物均采用快速推進的研發模式,存在一定程度的潛在風險,且臨床試驗開展過程中短時間納入大量受試者。藥審中心始終將新冠病毒疫苗、新冠病毒治療藥物的安全性放在首位,對新冠病毒疫苗、新冠病毒治療藥物臨床試驗加大安全監管力度、提高安全監管頻次、加強風險預警、提升安全監管的靈活性,對警戒信息第一時間進行處理,嚴守安全底線。確保了臨床試驗風險可控、受試者安全,盡早滿足了公眾對新冠病毒疫苗和新冠病毒治療藥物用藥安全的需求。
(三)建設中國上市藥品專利信息登記平臺
為貫徹落實《中共中央辦公廳、國務院辦公廳關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號)和《國家局、國家知識產權局關于發布〈藥品專利糾紛早期解決機制實施辦法(試行)〉的公告》(2021年第89號),探索建立藥品專利糾紛早期解決機制,對符合藥品專利糾紛早期解決機制的品種,依法設置等待期、專利保護期或市場獨占期。藥審中心建設了中國上市藥品專利信息登記平臺。
1.以問題為導向,充分聆聽社會各界意見建議
藥審中心加強溝通協調,多次邀請相關部門、業界專家召開平臺建設研討會,汲取行業專業性意見,及時發現解決問題,推進平臺建設。在中國上市藥品專利信息登記平臺測試期間,根據社會各界反映的問題,逐一解答并同步優化平臺功能。
2.發布操作指南等文件,提高用戶的平臺使用體驗
藥審中心發布《中國上市藥品專利信息登記平臺用戶操作指南》《中國上市藥品專利信息登記填表說明》等指導性文件,給予申請人明晰指導。2021年有325個上市許可持有人登記專利信息1476條,涉及藥品1090個;公開專利聲明959個,其中一類申明783個,二類申明65個,三類申明175個,四類申明97個,實現藥品注冊相關專利信息公開。
(四)扎實推進仿制藥一致性評價工作
1.持續開展參比制劑遴選工作
藥審中心根據《藥審中心化學仿制藥參比制劑遴選工作流程》要求,繼續規范遴選工作流程,有效提高工作效率,按時限完成參比制劑遴選工作。自2017年8月開展一致性評價工作以來共發布參比制劑目錄49批,涉及4677個品規(1967個品種),其中包括注射劑參比制劑1253個品規(477個品種)。2021年發布參比制劑850個品規(527個品種)。
2.繼續完善優化一致性評價工作
2021年已通過一致性評價331個品種。為了更好的開展一致性評價工作,藥審中心完成了我國上市化學藥品相關數據的梳理工作,對臨床價值明確無原研對照的品種、國產創新品種、我國特有品種等進行了分析研究,為下一步一致性評價工作提供了參考。2021年制定了75個品種的藥學研究技術要求,起草了27項生物等效性個藥指導原則,逐步完善了審評標準體系。同時,藥審中心召開一致性評價企業座談會,充分聽取企業提出的相關意見和建議,以企業關心的痛點難點問題作為下一步工作的重點。
3.優化一致性評價專欄
在藥審中心網站中優化了“仿制藥質量與療效一致性評價”專欄,設專人對一致性評價專欄進行更新和維護,及時更新通過一致性評價的口服固體制劑品種說明書、企業研究報告及生物等效性試驗數據、參比制劑目錄、政策法規、技術指南等信息。
(五)提高藥品審評審批透明度25
一是加大審評信息公開力度,建立審評信息公開的長效機制。藥審中心制定《藥審中心技術審評報告公開工作規范(試行)》,發布《2020年度藥品審評報告》,提高審評工作透明度。截至2021年底,已累計公開新藥技術審評報告500個。二是持續推進審評信息公開。在藥審中心網站增設“突破性治療公示”等欄目,對申請人關注度高的加快品種信息予以公開,同時上線異議解決系統,開通對審評結論提出異議的通道,及時回應社會關切。三是不斷加強信息化建設。對藥審中心網站進行升級改造。新增“兒童用藥”、“行政受理服務”、“指導原則”、“藥品電子通用技術文檔(eCTD)”等專欄,增強審評信息公開的主動性,信息檢索的便利性和信息更新的時效性,不斷滿足公眾和申請人訴求。四是深化“放管服”改革,加快實現“一網通辦”,推進藥監服務事項整體聯動。以建設整體聯動、高效便民的網上服務平臺為目標,整合內部賬戶體系,對接國家局網上辦事大廳,做到統一賬戶、入口和登錄。
2021年公開已承辦的注冊申請信息11546條,公示納入優先審評品種信息112個,公示納入突破性治療品種信息51個,公示溝通交流申請信息3757個,公開批準臨床默示許可申請信息2873個,公開上市藥品審評報告信息184個。公開登記審查通過、受理通過的原料藥、藥用輔料和藥包材任務2524個。2021年首次實現原料藥審評進度查詢,并實現與關聯制劑的關聯查詢,公開單獨審評原料藥進度任務927個及與關聯制劑的關聯查詢任務443個,持續推進審評進度公開。
(六)推動藥品注冊申請申報電子化
為推進藥品注冊申請電子申報,提高“互聯網+藥品監管”服務效能,eCTD項目正式實施。一是發布技術規范,指導申請人準備eCTD申報資料。制定eCTD技術規范、實施指南等技術文件,為申請人準備電子申報資料提供技術指導和標準遵循。二是開展宣貫工作,提高申請人開展eCTD申報的積極性。制定宣講解讀計劃,開展對外宣講,幫助申請人理解eCTD技術要求和申報流程。三是做好相關信息化建設,方便申請人開展eCTD申報。建設eCTD專欄,集中公開國內外指導原則、工作動態等,建設eCTD申報系統,對接國家局藥品業務應用系統,打通藥品注冊申請全流程電子化通道。四是開展信息安全評估,提高信息安全性。開展eCTD等級保護測評、密碼應用安全性評估測評、網絡安全風險評估等,多措并舉,有效控制和降低信息安全風險。
第八章 支持推動中藥傳承創新發展
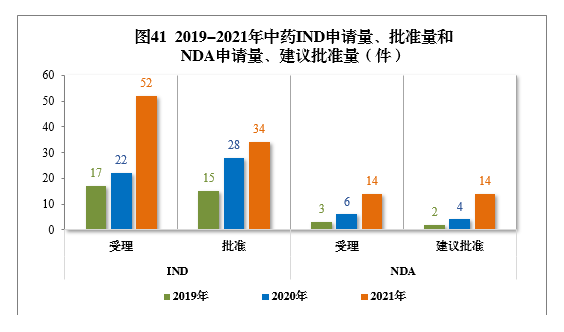
2019-2021年,中藥IND申請量(17件、24件、52件)、批準量(15件、28件、34件)和NDA申請量(3件、6件、14件)、建議批準量(2件、4件、14件)均呈現連年增長的態勢。2019-2021年中藥IND申請量、批準量和NDA申請量、建議批準量詳見圖41。
(一)落實改革完善中藥審評審批機制要求,推動構建“三結合”26注冊審評證據體系
認真落實《中共中央 國務院關于促進中醫藥傳承創新發展的意見》和習近平總書記關于改革完善中藥審評審批機制指示精神,按照傳承精華、守正創新、高質量發展的原則,深刻研究總結中藥審評審批實踐經驗和藥品審評審批制度改革成果,結合中藥特點和研發實際情況,積極主動研究中藥注冊分類調整意見,加快構建“三結合”注冊審評證據體系,暢通了中藥新藥的注冊途徑。
基于“三結合”注冊審評證據體系,制定審評標準和指導原則。針對“三結合”注冊審評證據體系下研究策略、方法的調整和溝通交流關注點,將目前已形成的人用經驗的共識轉化到指導原則之中,發布了《中藥新藥復方制劑中醫藥理論申報資料撰寫指導原則(試行)》《古代經典名方中藥復方制劑說明書撰寫指導原則(試行)》。選擇惡性腫瘤、慢性胃炎、胃食管反流病3個具體適應癥為突破口,引入真實世界研究等新工具新方法,與中醫臨床相關適應癥領域的權威專家一起針對符合中醫藥特點的臨床療效評價技術要求進行研究,逐步形成指導原則。
(二)研究優化注冊分類,開辟古代經典名方中藥復方制劑研發與審評新路徑
藥審中心對現行《藥品注冊管理辦法》中藥分類中的第3類“古代經典名方中藥復方制劑”進行了系統研究,基于“三結合”注冊審評證據體系思維,增加了“3.2類其他來源于古代經典名方的中藥復方制劑”分類,并提出了一系列與之相適應的注冊管理要求。該分類體現了傳承精華、守正創新的原則,有別于中藥創新藥的研發模式,對于加快來自中醫長期臨床實踐傳承下來的經典名方、名老中醫經驗方以及醫院制劑等的成果轉化,充分滿足中醫臨床治療需求,具有十分積極的意義。通過“三方”相關品種的審評,實踐了與該分類相適應的審評程序、臨床及藥學審評要點和技術要求,得到了中醫藥院士、國醫大師等權威專家的高度贊揚。
按照國家局、國家中醫藥管理局工作部署,藥審中心持續推進古代經典名方中藥復方制劑專家審評委員會的組建工作。
(三)持續加強標準研究,構建符合中藥特點的全過程質量控制體系
遵循中醫藥理論、傳統用藥經驗和中藥研發規律,深入研究中藥特點和中藥審評標準,建立完善中藥新藥全過程質量控制體系,制定符合中藥特點的研究和評價技術指導原則,轉變中藥“唯成分”的質量控制理念,基本構建涵蓋藥材、飲片、制劑等的中藥新藥全過程質量控制體系和全生命周期管理的有關要求。發布了《中藥新藥質量研究技術指導原則(試行)》,該指導原則一方面重視中藥臨床長期使用證明安全、有效的事實,以臨床價值為導向,尊重中醫藥傳統和特色,引導生產企業制定符合中藥特點的質量控制方法和策略;另一方面強調“質量源于設計”、“全過程質量控制”等理念,指導生產企業更加有效地控制產品質量。
深入研究、總結近幾十年來中藥變更研究以及中藥變更監管的經驗和成果,破除“唯成分”的評價方式,基于生產過程、人用經驗和質量評價,構建了新的變更研究評價標準,發布了《已上市中藥藥學變更研究技術指導原則(試行)》,優化已上市中藥藥學變更技術要求,解決長期困擾企業的難點痛點問題,推動中藥產業高質量發展。
(四)加強對申請人的指導,加快確有臨床價值的中藥新藥審評
藥審中心將具有明顯臨床價值的中藥新藥納入優先審評審批程序。通過問詢式溝通交流、專業問詢、線上視頻會議等多種方式,主動與申請人就針對關鍵技術問題的溝通交流,使申請人在專家咨詢會上答辯更為聚焦,提高了補充資料以及說明書、質量標準等審評所需文件撰寫的質量和效率。全力以赴加快中藥上市許可申請審評,發揮中醫藥在疾病防治中的獨特優勢。
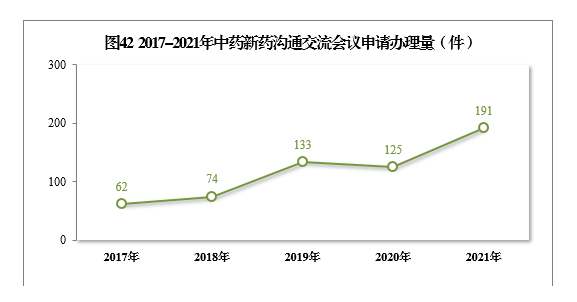
自《藥物研發與技術審評溝通交流管理辦法》發布以來,中藥新藥溝通交流會議申請的辦理量不斷增加,從2017年62件、2018年74件,增加至2019年133件、2020年125件、2021年191件。通過與申請人的溝通交流,前置處理申報資料存在的問題,提高了申報資料質量和審評工作效率。2017-2021年中藥新藥溝通交流會議申請辦理量詳見圖42。
(五)積極做好援疆援藏工作,支持促進民族藥發展
按照國家局的部署和工作要求,藥審中心多次赴新疆、西藏等民族地區開展調研、培訓、座談,深入了解民族藥研發實際情況和存在的問題,探索調整民族藥注冊管理思路,推進具有民族藥臨床治療優勢藥物的研發。通過線上答疑等方式解答新疆、西藏民族藥企業咨詢問題數百條,及時解決申請人在研發和注冊過程中的問題。積極推動民族藥品種的研發,優先配置審評資源、加強注冊服務指導、做好審評全過程的溝通交流。
第九章 審評體系和審評能力現代化穩步提升
(一)保障連任ICH管委會成員相關工作
ICH工作辦公室為保障國家局成功連任ICH管委會成員,一是爭取各ICH成員的理解和支持,積極籌辦“ICH中國進程與展望會”,向國際行業協會全面展示了我國ICH工作成果;組織參加了藥品信息協會(DIA)中國年會ICH主題日活動,圍繞推動ICH國際協調等議題與來自歐美日機構代表進行深入交流;與日本監管機構聯合舉辦研討會,全面深化與國際監管機構和工業界的交流合作。二是提高在行業代表領域的宣傳力度,2021年4月28日舉辦了“ICH指導原則實施情況宣講會”,線上觀看直播人數達1.4萬人次,回放1.1萬人次。三是密切關注ICH管委會選舉進程,深入研究,積極籌備ICH管委會選舉申請材料,為國家局成功連任ICH管委會成員奠定了堅實的基礎。2021年6月3日國家局再次當選ICH管委會成員。
(二)積極推動ICH指導原則轉化實施和議題協調工作
一是ICH工作辦公室進一步推動ICH指導原則在國內的落地實施,2021年報請國家局發布ICH指導原則實施適用公告6個,明確了9個ICH指導原則的實施時間節點。截至2021年底,國家局已充分實施ICH指導原則53個,實施比例達84.13%。二是ICH工作辦公室深入參與ICH議題協調工作。目前ICH共有活躍議題28個,向ICH議題協調專家工作組選派專家53人次,共參加工作組電話會累計達379次。
(三)流程導向科學管理體系建設更加科學
在中央紀委國家監委駐市場監管總局紀檢監察組及國家局黨組的支持和指導下,藥審中心科學管理體系8個子課題的試點建設運行良好,科學管理體系制度計劃制修訂28個,已發布制度17個,58項改革措施穩步推進。2021年藥審中心內部審評以流程為導向的科學管理體系基本建成,制度標準體系和風險防控機制進一步完善、審評流程更加清晰、審評審批效率明顯提高、服務意識顯著增強、服務對象滿意度和社會美譽度明顯提高,以問題為導向、流程為主線、制度建設為抓手的藥品審評審批工作體系基本形成。同時,藥審中心總結流程導向審評體系的建設成果,對《藥品技術審評質量管理規范》(GRP)進行了修訂。以此為新起點,按照推進治理體系和治理能力現代化新要求,藥審中心將繼續發揮以流程導向科學體系建設工作機制作用,堅持問題導向,不斷發現新問題,研究新措施,持續推進審評體系和審評能力現代化。
(四)人才隊伍建設邁出堅實步伐
藥審中心積極開展人才隊伍建設,樹立鮮明用人導向,堅持嚴管和厚愛結合、激勵和約束并重,鼓勵工作人員銳意進取、擔當作為。一是持續加強審評隊伍和能力建設。積極協調增加人員編制,立足審評需要做好人才引進工作,充實專業審評力量,持續開展員工教育培訓,提高工作能力。二是暢通員工職業發展通道。做好高級職稱評審申報,積極開展專業技術崗位評審聘任、主審審評員選聘,做好中級職稱以及管理崗位級別認定工作,破除人才職業發展瓶頸。三是不斷加強制度建設,制定《員工辭職管理辦法》《職工兼職(任職)管理辦法》《考勤與休假管理辦法》《因私出國(境)管理辦法》等11個制度,夯實了人才隊伍管理的基礎。四是完善績效考核等措施,進一步規范各類人員激勵和約束機制。
(五)指導規范藥品分中心開展審評工作
設立藥品審評檢查長三角分中心、藥品審評檢查大灣區分中心(以下簡稱藥品分中心)是黨中央、國務院在長三角區域、粵港澳大灣區推進更高起點深化改革和更高層次對外開放等戰略部署和發展規劃的重要舉措,是對藥品審評改革創新和藥品審評能力建設的強化支持。藥審中心在國家局的統一領導下,堅決貫徹國家區域戰略,認真落實“統一審評團隊、統一業務管理、統一審評系統、統一審評標準”要求,大力加強藥品分中心建設工作的規劃設計、建設運行及支持保障,加大業務支持指導力度,加強業務培訓,推動藥品分中心盡快發揮應有作用,助力區域醫藥產業高質量發展。
一是建立藥品分中心業務工作協調機制。藥審中心成立專項工作組,專題研究推進藥品分中心業務開展、人才隊伍建設等工作,全力推進藥品分中心逐步開展審評工作。二是多種形式組織培訓。藥審中心通過線上培訓、線下一對一帶教等形式,對藥品分中心人員開展了涵蓋審評任務管理、專家會議、溝通交流、技術審評等方面的業務培訓,促進藥品分中心人員審評業務能力的提升。三是支持指導藥品分中心開展溝通交流相關工作。針對具有臨床價值的重點品種,藥審中心給予技術支持,支持藥品分中心對區域內申請人開展指導和交流工作,2021年共組織溝通交流會議17次;發布《國家藥品監督管理局藥品審評檢查長三角分中心、大灣區分中心關于啟動一般性技術問題解答工作的通知》,開通申請人向藥品分中心提交一般性技術問題端口,指導藥品分中心解答一般性技術問題咨詢1415個。四是開展上市后變更研討會和培訓。在上海和深圳召開了“藥品上市后變更類別確認研討會”,建立藥審中心與藥品分中心、省級藥監局關于上市后變更分類確定的溝通協調機制。選派人員前往2個藥品分中心開展藥品上市后變更指導原則的培訓,長三角區域約兩千人參加培訓,粵港澳大灣區約五百人參加培訓。
兩個藥品分中心掛牌運行以來,主動服務,深入調研了解區域內藥品企業服務需求,積極解決企業新藥研發與注冊中遇到的突出問題。后續藥審中心將會同兩個藥品分中心進一步深化審評審批制度改革,有效提升藥品分中心服務區域醫藥產業創新發展的工作質量,指導支持藥品分中心推動建設政治過硬、素質優良、高效廉潔的審評人才隊伍。
第十章 加快完善藥品技術指導原則體系
近年來,隨著醫藥產業迅猛發展,新技術、新靶點、新機制、新成果不斷涌現,藥品注冊申報數量持續增加,大批創新型高科技藥物進入注冊審批程序。為滿足藥品更新換代速度和醫藥行業發展需求,藥品技術指導原則在具有規范性、指導性和應用效果的同時還必須具有前瞻性。藥審中心以滿足藥物研發需求和鼓勵創新為目標,持續推進審評體系和審評能力現代化建設,致力于構建科學權威公開的審評標準體系,解決影響和制約藥品創新、質量、效率的突出問題。
根據《國家藥監局綜合司關于印發藥品技術指導原則發布程序的通知》(藥監綜藥管〔2020〕9號)要求,藥審中心加大指導原則的起草制定力度,2021年經國家局審查同意發布了87個指導原則。開展藥品審評標準體系建設以來,已累計發布了361個指導原則,覆蓋中藥、化學藥、生物制品等領域,包含新冠病毒治療藥物、古代經典名方、細胞和基因治療等研發熱點難點問題。目前國內指導原則已基本形成技術標準體系,為醫藥產業的創新發展和藥品審評提供了科學有力的技術支撐。2021年藥審中心完成的技術指導原則詳見附件7。
在加速推動新冠病毒治療藥物研發上市方面,藥審中心發布了《新型冠狀病毒中和抗體類藥物非臨床研究技術指導原則(試行)》《抗新冠病毒肺炎炎癥藥物非臨床藥效學研究與評價技術指導原則(試行)》《抗新冠病毒化學藥物非臨床藥效學研究與評價技術指導原則(試行)》等指導原則,緊跟國內國際新冠肺炎疫情的發生發展及臨床治療需求,以新冠病毒中和抗體類藥物、抗新冠病毒肺炎炎癥藥物和抗新冠病毒化學藥物作為抗疫藥物研發和審評審批的重點,更好地指導相關藥物的研發。
在支持推動中藥傳承創新發展方面,發布了《古代經典名方中藥復方制劑說明書撰寫指導原則(試行)》《中藥新藥復方制劑中醫藥理論申報資料撰寫指導原則(試行)》《按古代經典名方目錄管理的中藥復方制劑藥學研究技術指導原則(試行)》等指導原則,加快構建中醫藥理論、人用經驗和臨床試驗相結合的中藥注冊審評證據體系,規范中醫藥理論申報資料和古代經典名方中藥復方制劑說明書相關內容的撰寫。
在滿足兒童用藥臨床急需、促進兒童用藥研發創新方面,發布了《兒童用化學藥品改良型新藥臨床試驗技術指導原則(試行)》《化學藥品和治療用生物制品說明書中兒童用藥相關信息撰寫的技術指導原則(試行)》等指導原則,鼓勵藥物研發者研發適宜兒童使用的劑型和規格,同時通過完善藥品說明書中兒童用藥信息以指導臨床合理用藥,持續解決臨床兒童用藥緊缺問題。
在細胞和基因治療方面,發布了《基因修飾細胞治療產品非臨床研究技術指導原則(試行)》《基因治療產品非臨床研究與評價技術指導原則(試行)》《基因治療產品長期隨訪臨床研究技術指導原則(試行)》等指導原則,規范了國內細胞和基因治療藥物的研究與評價,進一步提高企業研發效率,引導行業健康發展。
在腫瘤藥物研發發面,發布了《以臨床價值為導向的抗腫瘤藥物臨床研發指導原則》《生物標志物在抗腫瘤藥物臨床研發中應用的技術指導原則》《抗腫瘤藥首次人體試驗擴展隊列研究技術指導原則(試行)》等指導原則,從患者需求的角度出發,對抗腫瘤藥物的臨床研發提出建議,以期指導醫藥企業在研發過程中,落實以臨床價值為導向、以患者為核心的研發理念,促進了抗腫瘤藥物科學有序的開發。
在罕見病治療方面,發布了《罕見疾病藥物臨床研發技術指導原則》,意在促進更多低發病率疾病為對象的藥物研發,展現了藥審中心推動我國罕見疾病藥物研發的信心和決心,力爭將更多原先被市場冷落的罕見疾病藥物拉入研發快車道,為邊緣化的罕見病患者帶來更多希望的曙光。同時針對罕見病藥物研發積極性較低的突出問題,促使醫藥企業圍繞尚未滿足的臨床需求,將罕見病作為創新產品研發的重要方向之一。而最終目的,是為了推動我國罕見病防治與保障邁上新的臺階,為罕見病患者提供更優質的診療服務,保障人民的健康權益。
在真實世界數據方面,發布了《用于產生真實世界證據的真實世界數據指導原則(試行)》,從審評角度明確了用于回答臨床科學問題的數據要求,強調了真實世界數據不等同于真實世界證據,為工業界利用真實世界數據支持藥物研發提供了科學可行的指導意見。該指導原則的發布,使我國真實世界數據研究在政策監管層面邁向全球第一梯隊。
在藥品上市后變更方面,發布了《已上市中藥藥學變更研究技術指導原則(試行)》《已上市化學藥品藥學變更研究技術指導原則(試行)》《已上市生物制品藥學變更研究技術指導原則(試行)》等指導原則,旨在落實藥品全生命周期管理,指導我國已上市中藥、化學藥品和生物制品藥學的變更研究,為申請人提供可參考的技術標準。
指導原則的制定與發布進一步完善了藥品審評體系,為科學公正的審評決策提供了有力的技術支撐。同時,鼓勵科研機構、申請人和行業協會更多地參與藥品指導原則編制工作,使藥品指導原則體系構建工作形成良性循環,進而更好的推動我國藥品指導原則體系更加完善。
第十一章 黨風廉政建設見行見效
藥審中心以習近平新時代中國特色社會主義思想為指導,增強忠誠擁護“兩個確立”,堅定踐行“兩個維護”的政治自覺,以落實管黨治黨政治責任的有力成果,為推進藥品審評改革創新提供了堅強政治保障。
一是認真開展好黨史學習教育。制定《藥審中心黨委開展黨史學習教育實施方案》,召開動員部署大會,成立督導組指導各黨支部利用“三會一課”、組織生活會等多種形式推進黨史學習教育。
二是積極開展好“我為群眾辦實事”實踐活動。圍繞公眾和申請人急難愁盼的現實問題,將國家局“藥品監管惠企利民十大項目”中涉及藥審中心為責任單位的4個項目作為工作重點認真抓好落實,確立了加快推進新冠病毒疫苗審評、鼓勵兒童藥研發創新、推進審評信息公開、不斷優化溝通交流機制、持續提升服務申請人質量等25個辦實事項目,不斷滿足業界和公眾訴求。
三是統籌抓好中央、國家局黨組巡視整改及違反中央八項規定精神專項治理各項工作,通過建章立制、優化流程、加強督辦等手段協調并推動解決整改過程的難點堵點問題。通過巡視整改不斷提升整體工作水平。
四是開展重點任務專項監督。對疫情防控、原輔包關聯審評審批、新冠病毒疫苗審評審批等落實情況進行重點監督,推動藥品審評制度改革重要工作落地見效。對于審評暫停品種的暫停原因、納入突破性療法程序的品種依程序溝通交流執行情況等開展常態監督,著力防范化解風險隱患,壓實責任。
五是持續防范和化解廉政風險。落實上級紀檢組織關于“行賄受賄一起查”要求,制定藥品注冊申請人行為合法合規承諾書。組織員工進行利益沖突情況報告,開展員工經商辦企業持股清查工作,推動建設清正廉潔的審評審批環境。
六是堅持警示教育常態化。制定年度廉政文化建設方案,每兩月編印1期《廉潔審評教育專刊》,每月向全體員工推送廉潔警句,大力營造崇廉尚廉的濃厚氛圍。
第十二章 2022年重點工作安排
過去的一年間,藥品技術審評工作在鼓勵醫藥創新、維護人民健康和公共衛生安全方面作出了積極的貢獻,在保障疫情防控大局和加快醫藥產業高質量發展中的關鍵性作用也愈加顯著。隨著藥品審評審批制度改革不斷向縱深推進,人民群眾對藥品質量和安全有著更高的期盼,醫藥行業對公平、有序、可預期的審評環境的訴求更加強烈,以及在全球公共衛生危機頻發、“全球新”藥物創新性不斷提升等復雜的社會背景下,我國藥品審評機構、藥品審評能力和藥品審評體系現代化方面依然面臨著諸多挑戰。
一是審評隊伍規模與審評任務量匹配失衡。目前,審評隊伍力量與每年按時限審評上萬件注冊申請任務量之間的矛盾依然突出,加班加點審評仍是常態。二是藥品審評能力現代化水平仍需全面加強。隨著新藥研發創新全球化不斷提升,新機制、新靶點等“全球新”的藥物逐漸增多,創新產品對審評能力的挑戰和壓力已日漸凸顯。三是如何更好地強化藥品審評效能、提升為人民服務水平、建立健全現代化藥品審評體系的問題變得更加突出。
2022年,藥審中心將在國家局黨組的堅強領導下,緊密圍繞各項重要工作部署,主要開展以下方面的工作。
(一)全力保障新冠病毒疫苗藥物審評
服務疫情防控大局,全力保障新冠病毒疫苗擴產能、保質量、保供應;嚴守藥物研發安全有效標準,堅持提前介入、研審聯動、科學嚴謹、依法合規,全力以赴推動新冠病毒疫苗和治療藥物上市,持續跟進各技術路線疫苗藥物品種研發進展,加快促進重點藥物研發創新,督促附條件上市疫苗藥物生產企業開展上市后研究;總結固化好的經驗做法,優化應急審評工作機制,促進應急審評工作經驗轉化實施;加強新冠應急審批藥物臨床試驗進展與安全信息監管。
(二)持續深化藥品審評審批制度改革
促進醫藥產業基礎性研究,支持鼓勵企業在現代醫藥新技術、新靶點、新機制方面開展創新,促推解決產業創新發展的“卡脖子”問題;堅持鼓勵以臨床價值為導向的新藥好藥、罕見病用藥、重大傳染病用藥、公共衛生方面的臨床急需藥品研發創新;細化優化突破性治療藥物、附條件批準、優先審評審批程序,促進藥品高質量發展;支持滿足臨床需求的兒童用藥研發創新,提高兒童用藥的安全性和可及性;鞏固按時限審評改革成果,完善審評任務管理機制;強化“放管服”意識,提升溝通交流服務質量;優化藥物臨床試驗默示許可制度;完善專家咨詢委員會工作制度;加強藥品注冊核查檢驗溝通協調,做好《藥品注冊核查檢驗啟動工作程序》配套制度落地實施;加強臨床試驗期間的藥物警戒體系建設,提升臨床試驗信息管理能力;穩步推進eCTD工作,提升電子化管理水平。
(三)加快推動中藥審評審批機制改革
完善中藥審評審批機制,加快構建以中醫藥理論、人用經驗和臨床試驗相結合的中藥審評體系;推進中藥技術指導原則制修訂,建立完善符合中藥特點的審評體系,促進中藥傳承創新發展;加快組建古代經典名方中藥復方制劑專家審評委員會。
(四)扎實推進仿制藥質量和療效一致性評價
堅持標準不降低,有序推進口服固體制劑、注射劑一致性評價工作;嚴格評價標準,完善相關技術指導原則體系;優化一致性評價流程,加快參比制劑遴選工作,推進無參比制劑品種梳理及國產創新藥自證工作。
(五)全面開展審評體系和審評能力現代化建設
做好藥品安全專項整治配合工作;在國家局統一領導下加快推進藥品長三角分中心、藥品大灣區分中心業務等方面建設;持續推進流程導向科學管理體系建設,完善科學審評體系,規范權力運行,防范各類風險;加強長效機制建設,加快將科學管理體系的建設成果轉化為規章制度落地落實,提升審評科學化水平,不斷提升審評質量和審評效率;做好疫苗國家監管體系(NRA)評估迎檢;推進以臨床價值為導向的指導原則建設;推進ICH指導原則轉化實施,促進國內行業監管與國際標準接軌;推進監管科學課題研究;加強法務工作,提升職工法律意識和依法決策水平;充實審評力量,優化專業結構,加強審評隊伍建設;加強業務培訓,探索完善培訓考核與評價機制。
(六)馳而不息強化黨風廉政建設
持之以恒學深悟透做實習近平新時代中國特色社會主義思想,認真學習黨的二十大精神,深刻認識“兩個確立”的決定性意義,堅決貫徹習近平總書記的重要講話、重要指示精神,不斷增強“四個意識”,堅定“四個自信”,做到“兩個維護”;認真貫徹黨中央、國務院重大決策部署,鞏固落實中央八項規定精神;持續推進“不敢腐、不能腐、不想腐”體制機制建設;做好防范利益沖突工作;豐富新聞宣傳方式,打造系統化宣傳格局,弘揚藥品審評審批制度改革成果。
結 語
行之力則知愈進,知之深則行愈達。2022年,藥審中心將繼續以習近平新時代中國特色社會主義思想為指導,認真貫徹落實習近平總書記重要指示批示、黨的十九大和歷次全會精神,深刻領會“兩個確立”的決定性意義,增強“四個意識”,堅定“四個自信”,堅決做到“兩個維護”,以革故鼎新的勇氣、堅忍不拔的定力,抓好“十四五”藥品安全及高質量發展規劃的貫徹落實,全面加強黨的建設,縱深推進全面從嚴治黨,持續深化藥品審評審批制度改革,深入開展藥品安全專項整治行動,不斷加大審評隊伍建設管理力度,扎實做好新冠病毒疫苗藥物應急審評工作,大力支持中醫藥傳承創新發展,有序推進仿制藥質量和療效一致性評價,不斷提升藥品審評體系和審評能力現代化水平,全力服務疫情防控工作大局,切實保障人民群眾用藥安全有效可及。
以初心,致創新。做好藥品審評工作使命光榮、責任重大。藥審中心將更加緊密團結在以習近平同志為核心的黨中央周圍,把握大勢、搶占先機,肩負起新時代賦予的重任,心懷“國之大者”,以不負人民的實際行動奮力開創藥品審評事業新局面,加快建設科學、高效、權威、公眾信賴的藥品審評機構,以優異成績迎接黨的二十大勝利召開,為守護人民生命健康和建設社會主義現代化國家、實現中華民族偉大復興的中國夢作出新的更大貢獻!
注解:
1此數據包含以醫療器械作用為主的藥械組合產品4件,不包含原料藥;本報告中“注冊申請”的數量單位為“件”,以受理號計算。
2原國家食品藥品監督管理總局、現國家藥品監督管理局在本報告中統稱為國家局。
3包括無需技術審評的補充申請和臨時進口注冊申請。
4在受理需技術審評的注冊申請9235件的基數上,此數據不含藥械組合產品4件。
5包含民族藥。
6以補充申請途徑申報。藥審中心自2017年8月開始承擔仿制藥質量和療效一致性評價工作。
7本章創新藥包含按照現行《藥品注冊管理辦法》(國家市場監督管理總局令第27號)注冊分類中藥、化藥、生物制品1類和原《藥品注冊管理辦法》(國家食品藥品監督管理局令第28號)注冊分類中藥1-6類、化藥1.1類、生物制品1類受理的藥品。
8本報告中“品種”的數量單位為“個”,均以通用名稱計。
9化學藥5.1類為境外上市的原研藥品和改良型藥品的境內上市。
10臨床試驗申請包括IND和驗證性臨床試驗申請。
11創新化學藥IND 1134件(487個品種),NDA 32件(21個品種)。
12創新生物制品IND 643件(423個品種),NDA 23件(16個品種)。
13藥物臨床試驗申請、一致性評價申請、補充申請、境外生產藥品再注冊申請。
14自2017年5月1日,藥審中心根據《國家食品藥品監督管理總局關于調整部分藥品行政審批事項審批程序的決定》(國家食品藥品監督管理總局令第31號),開始以國家局名義對部分注冊申請作出藥品行政審批決定。
15本報告所稱“審結”包括:完成技術審評報送國家局審批、完成技術審評后以國家局名義審批、不需要技術審評以國家局名義直接審批、審評審批程序終止。“審結”不包含已完成至少一輪技術審評,因需申請人補充資料、發出補充資料通知書的注冊申請(以下簡稱待申請人回復補充資料)。
16含藥械組合注冊申請8件。
17不含藥械組合注冊申請8件。
18 本報告中的原研藥,為通過系統完整的研究,并證明安全有效、質量可控的藥品。
19根據《國家藥品監督管理局、國家衛生健康委員會關于臨床急需境外新藥審評審批相關事宜的公告》(2018年第79號),藥審中心先后遴選并發布三批臨床急需境外新藥名單共81個品種。
20本章創新藥包含按照現行《藥品注冊管理辦法》(國家市場監督管理總局令第27號)注冊分類中藥、化藥、生物制品1類和原《藥品注冊管理辦法》(國家食品藥品監督管理局令第28號)注冊分類中藥1-6類、化藥1.1類、生物制品1類審結的藥品。
21藥物臨床試驗申請、一致性評價申請、補充申請、境外生產藥品再注冊申請及其復審注冊申請。
22無需技術審評的補充申請、臨時進口注冊申請。
23基于風險啟動的注冊核查任務不包含新冠病毒治療藥物、新冠病毒疫苗的現場核查、有因檢查。
24《藥審中心關于業務咨詢服務聯絡方式的通知》見藥審中心網站(www.cde.org.cn)。
25數據來源為藥審中心網站“信息公開”專欄。
26中醫藥理論、人用經驗、臨床試驗相結合的中藥注冊審評證據體系。
(來源:國家藥品監督管理局官網)