仿制藥一致性評價中的博弈及政策建議
摘要
目的:探討政府促進國內制藥企業(簡稱藥企)參與仿制藥一致性評價的最優決策。方法:利用博弈論方法分析國內藥企與政府在仿制藥一致性評價問題的博弈均衡。結果:可能會產生兩種均衡,一種是地方各級政府相關部門均嚴格執行一致性評價政策,藥企則選擇積極參與一致性評價;另一種是地方各級政府相關部門執行政策不統一,如適當“延期”,且在省級帶量采購中允許非過評品種中標,那么可能會導致部分藥企過評積極性不大,因為不參加一致性評價的成本更低。結論:為鼓勵仿制藥企業參與一致性評價,地方各級政府相關部門應嚴格執行一致性評價政策,同時應出臺相關配套和激勵措施,如帶量采購、優先審評和審批等,提高過評企業的凈收益。
關鍵詞:仿制藥;一致性評價;博弈;成本;利潤;政府
Policy Game and Government Countermeasures on Consistency Evaluation of Generic Drugs
Key words:generic drugs;consistency evaluation;game theory;cost;profit;government
中圖分類號:R954 文獻標志碼:A
2016年2月,《國務院辦公廳關于開展仿制藥質量和療效一致性評價的意見》(國辦發〔2016〕8號)中提出,首批需要開展一致性評價的仿制藥有289個品種。據不完全統計,共涉及17740個批準文號/注冊證號,1817家國內藥品生產企業和42家進口藥品企業。當同品種藥品通過一致性評價的生產企業達3家時,藥品集中采購就不再選用未通過一致性評價的品種;且第1家品種通過一致性評價后,3年后不再受理其他藥品生產企業相同品種一致性評價的申請。以此提高我國仿制藥的質量和療效,加速行業洗牌,鼓勵國內制藥企業(簡稱國內藥企)加大研發力度,通過產品質量和價格競爭實現行業聚集效應。通過一致性評價是帶量采購的前提條件,其提高了以公立醫療市場為主要銷售終端的國內藥企的市場門檻。因此,企業必然會權衡利弊,分析決策成本和利潤情況,選擇是否進行仿制藥一致性評價。本研究中利用博弈論分析國內藥企與政府在仿制藥一致性評價問題上的博弈均衡,并提出促進國內藥企參與仿制藥一致性評價的建議。現報道如下。
1.制藥企業對待一致性評價的理性決策
1.1 無市場風險時藥企決策
假設國內藥企為某種藥品進行一致性評價的投資成本為C,當前這種藥品的每年凈利潤為π前,通過一致性評價后每年凈利潤為π后,令π后>π前。假設每年凈利潤不變,該藥品分攤的固定成本忽略不計,市場利率為γ,且不變;那么國內藥企通過一致性評價后每年利潤為π后/(1+γ),折算到年初的現值為π后/(1+γ)n,當n→∞時,現值為π后/γ,只有現值大于期初一致性評價的投資時,該企業才會選擇一致性評價,即π后/γ>C。事實上,當前一致性評價投資約為1000萬元,假設市場利率為10%,只要通過仿制藥一致性評價的藥品每年能給企業帶來100萬元以上的凈利潤,企業就會有動力進行一致性評價。按利率為10%計算,該藥品增加銷售額只要超過1000萬元即可,估計許多企業都 能實現,但事實上真正實施仿制藥一致性評價的企業比例并不高。
1.2 市場不確定性制約企業決策
根據《總局關于仿制藥質量和療效一致性評價工作有關事項的公告(2017年第100號)》規定,企業參加國家帶量采購的前提條件是通過一致性評價,若假定企業能確定每年得到100萬元凈利潤,那么這些企業必然會做出實施仿制藥一致性評價的決策,但在實施過程中存在一定風險。主要風險有藥品是否能通過一致性評價,藥品是否能獲得100萬元凈利潤。假設這2種風險出現的概率分別為r1和r2,則企業選擇一致性評價的r1r2π后/γ>C(公式1),π后>γC/r1r2。可見,在其他條件不變,且r1和r2值較大,風險較小時,藥企越會選擇一致性評價;反之,則會拒絕。
2.制藥企業與政府的博弈
依據原國家食品藥品監督管理局要求,截至2018 年底,《國家基本藥物目錄(2012年版)》中2007年10月1日前批準上市的化學藥品仿制藥口服固體制劑 (289個目錄品種)應在2018年底前完成一致性評價。其中,需開展臨床有效性試驗和存在特殊情形的品種應在2021年底前完成一致性評價。逾期未完成的,不予再注冊。政府在促使企業參與仿制藥一致性評價時,還需考慮醫保支付情況及藥品供應問題。根據《國家藥品監督管理局關于仿制藥質量和療效一致性評價有關事項的公告(2018年第102號)》,在2018年12月31日前未完成仿制藥一致性評價的,“企業經評估認為屬于臨床必需、市場短缺品種的,可向所在地省級藥品監管部門提出延期評價申請,經省級藥品監管部門會同衛生行政部門組織研究認定后,可予適當延期。逾期再未完成的,不予再注冊。”因此,會有兩種策略,一是嚴格執行該文件,二是適當延期,甚至在省級帶量采購中也允許為過評品種中標;國內藥企也會有2種策略,一是參與,二是放棄。在政府嚴格執行該文件和企業參與一致性評價的前提下,企業凈收益為r1r2π后/γ-C,如果企業放棄、政府嚴格執行該文件的條件下,制藥企業就會損失前的市場收益,設為-π前/γ。若政府考慮到多數企業未能及時參與一致性評價,則會適當“延期”,即還會采購未通過一致性評價的仿制藥。此時,參與一致性評價的企業由于前期投入成本較高,可能不會有太多的市場擴容,要獨自承擔一致性評價的投資成本(-C),其凈收益為π前-C,未參與則會得到之前的利潤(π前)。由于仿制藥的進入,會與原研藥產生有效競爭,政府可減少醫保支出,設為C政,若沒有企業參與,政府還要嚴格 執行該文件,可能會讓原研藥壟斷醫院市場。此時,政府需要支出較高的醫保支出,高出部分設為-C原壟,若政府適當“延期”,藥企放棄參與時,政府會承擔潛在的損失,即藥企參與一致性評價時的成本結余,凈收益為-C政 。由此可得到政府與國內制藥企業間的博弈矩陣,詳見下圖。
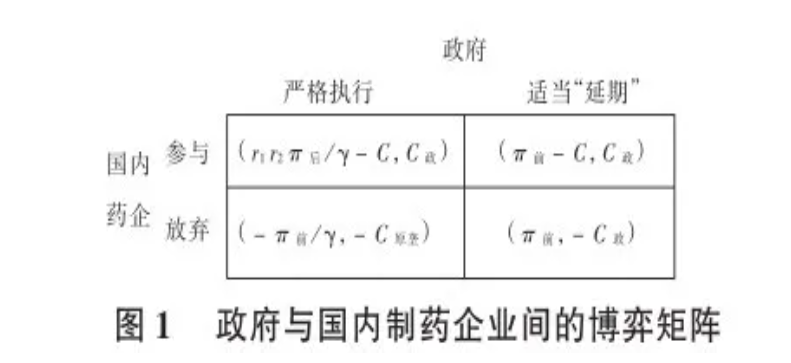
可見,若政府先行動,嚴格執行該文件,國內藥企選擇參與決策時,r1r2π后/γ-C>-π前/γ,即r1r2π后/γ+π前/γ>C(公式2)。與公式1相比,公式2更易滿足,即只要政府下定決心,嚴格執行一致性評價政策,制藥企業則更愿意參與一致性評價。2016年至2018年年初,申請參加一致性評價的企業較少,此后參與企業增多,這也驗證了這種推理。
國內藥企也可選擇“將軍”策略,即集體默契合謀,選擇放棄參與。此時,政府若嚴格執行該文件,就會承擔一定的原研藥壟斷成本,如果該成本較高,則政府備受財政壓力,可能會選擇“延期”策略,即當-C原壟 <-C政 時,政府選擇適當“延期”屬占優策略。一旦這種傾向被國內藥企所獲悉,那么基于利益考慮,必然會選擇放棄策略,此時國內藥企和政府間的博弈均衡為放棄和適當“延期”。
3.政策建議
3.1 政府嚴格執行政策,推動企業參與一致性評價
如果政府嚴格執行過評品種實現帶量采購等策略,那么國內藥企必然會有較大的積極性參加一致性評價。若參與過評企業較少(如沒有過評品種)時,政府可通過醫保談判政策,迫使過期原研藥降價,或鼓勵新藥研發,通過醫保談判盡快納入醫保,實現同類品種替代。這種均衡結果既鼓勵新藥研發,又能讓患者用上高質量的藥物。此時,政府可能面臨較大的醫保支出壓力,但從長期來看,理性企業會選擇過評,與原研藥爭奪市場。同樣,未參與一致性評價的國內藥企承擔的壓力會更大,特別是那些以醫院市場為主渠道的國內藥企,一旦失去這個市場,甚至失去某些批文,則意味著退出行業。因此,只有政府下定決心,釋放出一定要推進仿制藥一致性評價的信號,才會讓那些觀望的國內藥企參與一致性評價。當前,我國3次帶量采購中標結果顯示,絕大部分過評仿制藥實現原研替代,過期原研藥逐漸退出公立醫療市場,國內藥企實現市場規模“從零到1,從1到10”的跨越。從而實現雙贏,即政府節省醫保支出,國內藥企擴大市場規模,實現正常利潤。
3.2 政府制定配套政策,降低企業過評成本
在我國現行的醫療市場中,由于外資藥企依靠強大的技術和學術營銷資源,其原研藥即使過了專利期,依然會占據大部分市場,如波立維過專利期后5年,我國市場占有率依然為58.7%,下降了16.8%,而在全球市場中下降了82.9%。帶量采購,“以量換價,保證回款”是一個很好的配套政策,若真正執行到底,就能徹底打通仿制藥一致性評價的市場通路,提高通過仿制藥一致性評價后的藥品增加銷量概率(r2)。同時,若能將藥品費用節省部分歸醫院甚至醫師所有,則可激勵醫師開具價格更低的仿制藥。當前,我國政府正在推行疾病診斷相關分組(DRG)付費試點,目的是激勵醫師處方帶量采購中標品種(前提是過評),提高通過一致性評價藥品的市場銷售額,增加r2π后。如美國1994年仿制藥使用量僅為12%,而2000年達44%,2007年達75%。
3.3 政府合理激勵過評企業
自仿制藥一致性評價政策執行以來,我國各地政府制定相應政策,鼓勵本地區企業積極過評。2019年1月23日,北京市人民政府辦公廳發布《關于改革完善仿制藥供應保障及使用政策的實施意見》(京政辦發〔2019〕2號),提到“提高仿制藥一致性評價申報審批效率”“對承擔仿制藥一致性評價臨床試驗的醫務人員,在職稱晉升、科研獎勵和績效分配等方面予以支持”等措施,極大地提高了國內藥企的過評積極性。經過3批帶量采購,中標規則從1家增至8家,解決了過評企業無法中標的問題。由于依靠市場機制形成藥品價格是我國政府帶量采購的基本原則,故其中標規則實行淘汰制。在未來帶量采購中盡早過評和占領市場,同等機會下能優先選擇市場。因此,具有戰略眼光的國內藥企應盡快過評,但也要注意超過8家企業的品種和市場風險較高的問題。
綜上所述,是否能通過仿制藥一致性評價,即r1只有國內藥企自己了解,政府難以獲知,但可以提高過評品種的市場收益,如帶量采購政策中只有過評品種才可參與,且可分享50%~80%的公立醫療機構市場。前3輪帶量采購政策實施效果非常明顯,未來國家層面還會進行500個品種的帶量采購,地方政府則會進行其他藥品的帶量采購,還會優先采用過評品種,促使更多國內藥企推進仿制藥的一致性評價工作。
作者簡介:
第一作者:馬婷婷,女 ,回族 , 碩士研究生 , 研究方向為藥事管理。
通信作者:邢花,女,博士研究生,副教授,研究方向為藥事管理。
該文完整發布于《中國藥業》雜志2021年2月5日出版的第30卷第3期第1~3頁。
掃描下方二維碼即可查看本文全文及本期雜志其他內容↓↓↓
