特約稿 ? 劉昌孝院士|盤點2021:我國生物醫(yī)藥創(chuàng)新發(fā)展之淺見
盤點2021:我國生物醫(yī)藥創(chuàng)新發(fā)展之淺見*
Review 2021:A Preliminary Understanding of the Innovation and Development of China′s Biomedicine
劉昌孝
(天津藥物研究院· 釋藥技術與藥代動力學國家重點實驗室·天津市藥品監(jiān)管科學研究會)
*基金項目:中醫(yī)藥國際合作專項基金[0610 - 2040NF020928]
#作者簡介

劉昌孝,中國工程院院士、研究員、博士研究生導師。天津藥物研究院名譽院長、終身首席科學家和學術委員會主任,釋藥技術與藥代動力學國家重點實驗室主任,中國-東盟傳統(tǒng)藥物國際合作聯合實驗室主任,并擔任國家科技獎勵評審專家,國家藥品監(jiān)督管理局中藥監(jiān)管科學研究中心專家委員會主任,中國醫(yī)學科學院學部委員,國際藥物代謝研究會中國辦事處主任,國家藥品監(jiān)督管理局仿制藥一致性評價專家委員會副主任,天津藥學會、天津市藥品監(jiān)管科學研究會和天津學會學研究會理事長。我國藥代動力學的學科開拓者和學科帶頭人之一,從事藥理學、藥代動力學、現代中藥和中藥質量研究50余年,近10年致力于生物醫(yī)藥發(fā)展戰(zhàn)略研究,承擔和參與多項生物醫(yī)藥戰(zhàn)略咨詢研究項目。承擔包括國家“973”和“863”項目、國家科技部國際合作項目、國家重大專項課題、國家自然科學基金重點項目等國家重大研究項目50余項,發(fā)表論文450多篇,在國內外出版中英文學術專著30余部。曾獲得國務院特殊津貼,香港紫荊花醫(yī)學成就獎,全國勞模,全國優(yōu)秀科技工作者,國際藥物代謝研究會特別貢獻,中國藥學會突出貢獻獎和世界中醫(yī)藥聯合會中藥分析與標準終身成就獎。
摘要
目的:促進我國生物醫(yī)藥創(chuàng)新發(fā)展水平的提升。方法:回顧我國醫(yī)藥發(fā)展百年歷史,盤點2021年我國生物醫(yī)藥創(chuàng)新發(fā)展的成績、問題與挑戰(zhàn),提出關于生物醫(yī)藥創(chuàng)新發(fā)展形勢與模式的認識和展望。結果與結論:百年發(fā)展史展現了中國醫(yī)藥發(fā)展從無到有、從小到大、從仿到創(chuàng)、從無序競爭到有序競爭、從多頭管理走向科學管理的歷程,在黨的領導下,歷經70多年奮斗,我國醫(yī)藥創(chuàng)新能力大大提高。2021年,國產新藥申請上市數量達76件,主要涉及腫瘤、自身免疫系統(tǒng)、病毒和感染等疾病用藥,其中有不少“中國新”甚至“全球新”的創(chuàng)新產品,已接近發(fā)達國家水平;中醫(yī)藥特色發(fā)展有亮點,12個中藥新藥獲批上市,數量為近年新高;制藥企業(yè)從內卷需求向國際循環(huán)發(fā)展轉變,許可引進(License‐in)項目再創(chuàng)新高,達到100余起,且國產新藥對外許可(License‐out)已成大勢;國家鼓勵創(chuàng)新和監(jiān)管科學提升、創(chuàng)新藥企業(yè)專注研發(fā)創(chuàng)新與仿制藥企業(yè)專注質提高量、發(fā)展模式創(chuàng)新這三大發(fā)展紅利有力支撐了醫(yī)藥創(chuàng)新發(fā)展。為積極有效應對世界醫(yī)藥創(chuàng)新競爭帶來的挑戰(zhàn),我國醫(yī)藥行業(yè)(包括產業(yè)、商業(yè)、醫(yī)療、投資的整合)必須為可持續(xù)發(fā)展做好頂層設計,構建可持續(xù)的創(chuàng)新生態(tài)環(huán)境,促進和提升創(chuàng)新主體活力,認清我國制藥企業(yè)發(fā)展的短板,定位好我國創(chuàng)新藥領域的目標,才能為我國醫(yī)藥產業(yè)進入全球產業(yè)鏈從而提高全球市場份額提供保障。
關鍵詞:百年回顧;生物醫(yī)藥;發(fā)展成就;發(fā)展模式;發(fā)展挑戰(zhàn)
Key words:centennial review;biomedicine;development achievements;development model;development challenges
中圖分類號:R95 文獻標志碼:A
面對全球新冠疫情的嚴重壓力,我國疫情防控工作在“人民至上,生命至上”的價值理念指引下取得了舉世矚目的成就。在國家戰(zhàn)略指引下,2021年可以說是我國醫(yī)藥產業(yè)高質量創(chuàng)新發(fā)展承上啟下的一年,實現了“十四五”良好開局:醫(yī)藥創(chuàng)新在控制疫情、恢復醫(yī)藥產業(yè)經濟中發(fā)揮了突出作用,在從醫(yī)藥大國向醫(yī)藥科技強國轉變的征途中大步邁進;整個生物醫(yī)藥產業(yè)和創(chuàng)新生態(tài)環(huán)境系統(tǒng)逐步完善,醫(yī)藥創(chuàng)新在社會經濟發(fā)展中的戰(zhàn)略性地位更加顯著;醫(yī)藥產業(yè)鏈的韌性得到有效提升,實現了由量的增長向質的提升;以臨床價值為導向和以患者為中心的研發(fā)初衷推動了醫(yī)藥創(chuàng)新高質量發(fā)展,推出了多個具有一定國際影響力的創(chuàng)新醫(yī)藥產品和技術指導原則;醫(yī)藥創(chuàng)新能力已經成為國家產業(yè)經濟實力和強國要素的重要組成部分。
1 回首百年:醫(yī)藥發(fā)展歷經滄桑
2021年,恰逢中國共產黨建黨百年,梳理近百年醫(yī)藥發(fā)展史,可以看到中國醫(yī)藥發(fā)展的來之不易:從無到有、從小到大、從仿到創(chuàng)、從無序到有序競爭、從多頭到科學管理(表1)。回顧世界生物醫(yī)藥發(fā)展歷程,近幾十年除抗腫瘤藥和免疫調節(jié)藥之外的其他領域尚無很大突破,創(chuàng)新發(fā)展任務艱巨。當前,我國醫(yī)藥產業(yè)經過70多年奮斗,創(chuàng)新能力大大提高,但也要意識到平衡創(chuàng)新和發(fā)展的風險,以及世界格局和疫情因素可能會對醫(yī)藥產業(yè)創(chuàng)新格局的變化產生影響。

2 盤點 2021:我國生物醫(yī)藥發(fā)展成績斐然
2.1 高質量發(fā)展規(guī)劃和系列指導原則密集出臺,創(chuàng)新藥品加速批準
2021年12月30日,國家藥品監(jiān)督管理局(簡稱國家藥監(jiān)局)等8部門聯合印發(fā)《“十四五”國家藥品安全及促進高質量發(fā)展規(guī)劃》,明確了我國“十四五”期間藥品安全及促進高質量發(fā)展的主要發(fā)展目標,并制定出10個方面的主要任務。
到2021年年底,國家藥監(jiān)局藥品審評中心(CDE)已發(fā)布210多個藥品臨床試驗技術指導原則,其中2021年發(fā)布了26個(含10個最終稿和16個征求意見稿)關于抗腫瘤藥物臨床試驗的技術指導原則、8個關于抗菌藥物臨床試驗的技術指導原則。2021年7月2日,CDE《以臨床價值為導向的抗腫瘤藥物臨床研發(fā)指導原則(征求意見稿)》提出:“新藥研發(fā)應以為患者提供更優(yōu)的治療選擇為最高目標,當選擇非最優(yōu)的治療作為對照時,即使臨床試驗達到預設研究目標,也無法說明試驗藥物可滿足臨床中患者的實際需要,或無法證明該藥物對患者的價值。”該指導原則的發(fā)布,不僅對抗腫瘤藥的研發(fā)提出了更高要求,將加大醫(yī)藥企業(yè)新藥“真創(chuàng)新”開發(fā)難度,降溫“me too”行業(yè),也要求進行藥物研發(fā)時須秉承以臨床需求為根本出發(fā)點,以為患者提供實際臨床價值為最終目的,堪稱我國新藥研發(fā)史上的里程碑事件。
2021年,國家藥監(jiān)局共批準76個新藥(不包括疫苗,有4個國產疫苗創(chuàng)新產品獲批上市,其中3個為新冠疫苗),其中進口新藥37個、中藥創(chuàng)新藥12個、國產創(chuàng)新藥27個,年獲批新藥數量已接近發(fā)達國家水平。這些新藥主要涉及腫瘤、自身免疫系統(tǒng)、病毒和感染等疾病用藥,其中有不少“中國新”甚至“全球新”的創(chuàng)新產品,如國產首個新冠中和抗體聯合療法、國內首個CAR-T細胞療法產品、國產首個抗體偶聯藥物(ADC)新藥等。
在治療領域和適應證方面,近兩年獲批或報產一類新藥以抗腫瘤藥為主。據中國銀河證券統(tǒng)計數據,按治療領域分類,134個已獲批或進入報產階段的一類創(chuàng)新藥中,抗腫瘤藥61個(45.52%),抗感染用藥23個(17.16%),神經系統(tǒng)用藥10個(7.46%),血液系統(tǒng)用藥10個(7.46%),其他治療領域30個(22.39%)。抗腫瘤藥物是全球新藥研發(fā)的重點,也是臨床治療需求的真實反映和未來研發(fā)的永恒主題。
與此同時,我國醫(yī)藥研究者在國內外學術刊物上發(fā)表的研究論文也在世界范圍內產生了一定影響,特別是新冠疫情控制研究、傳統(tǒng)藥物研究、藥物研發(fā)平臺和合作發(fā)展等方面的進展,反映了國內醫(yī)藥創(chuàng)新發(fā)展的優(yōu)勢。
2.2 中醫(yī)藥特色發(fā)展有亮點
2021年,服務國家疫情防控需求,疫苗和中西藥物共同發(fā)展。遵從中藥研制規(guī)律,鼓勵中藥傳承創(chuàng)新,激發(fā)釋放了中藥創(chuàng)新的活力和潛能。據統(tǒng)計,2016年至2021年全球醫(yī)藥健康產業(yè)中共有21個中藥新藥獲批上市,平均每年4個。2021年就有12個中藥新藥獲批上市,數量為近5年最高,是過去每年的3倍。
2020年11月和12月,國家藥監(jiān)局和國家中醫(yī)藥管理局兩次聯合召開“經典名方”研發(fā)推進會,為鼓勵開發(fā)中醫(yī)藥遺產奠定了政策法規(guī)和技術共識基礎。2021年2月9日,國務院辦公廳《<關于加快中醫(yī)藥特色發(fā)展的若干政策措施>的通知》提出,“探索符合中醫(yī)藥特點的醫(yī)保支付方式,發(fā)布中醫(yī)優(yōu)勢病種,鼓勵實行中西醫(yī)同病同效同價”,并從夯實中醫(yī)藥人才基礎、提高中藥產業(yè)發(fā)展活力、增強中醫(yī)藥發(fā)展動力、完善中西醫(yī)結合制度、實施中醫(yī)藥發(fā)展重大工程、提高中醫(yī)藥發(fā)展效益、營造中醫(yī)藥發(fā)展良好環(huán)境等7個方面提出了具體要求。
2021年2月10日,國家藥監(jiān)局、國家中醫(yī)藥管理局、國家衛(wèi)生健康委、國家醫(yī)保局聯合發(fā)布《關于結束中藥配方顆粒試點工作的公告》(2021年第22號),結束了長達20年的中藥配方顆粒試點工作,規(guī)定了中藥配方顆粒品種實施備案管理,其質量監(jiān)管納入中藥飲片的管理范疇,由相關部門研究制定或明確其臨床使用、價格、醫(yī)保支付等方面的政策。這一定位凸顯出了中藥飲片的主體性,中藥配方顆粒的臨床應用,給醫(yī)生和患者多了一種選擇。
2.3 創(chuàng)新研發(fā)從內卷需求向國際循環(huán)發(fā)展轉變
2021年,我國制藥企業(yè)許可引進(License‐in)項目再創(chuàng)新高,達到100余起。創(chuàng)新研發(fā)呈現了更加多樣的變化,如國內制藥企業(yè)間的相互授權更加頻繁,傳統(tǒng)制藥企業(yè)參與程度更加深入,引進的研發(fā)進度越來越早等。我國制藥企業(yè)正在成為國際循環(huán)中越來越重要的角色,顯現出創(chuàng)新需求和培育創(chuàng)新能力的需求。
隨著我國制藥企業(yè)研發(fā)實力不斷提升,順應改革開放、創(chuàng)新發(fā)展的對外許可(License-out)模式使中國新藥研發(fā)進入到世界市場,通過授權或共同開發(fā)的模式,讓國內制藥企業(yè)走向世界市場發(fā)展。2019年12月14日以來發(fā)生的10起中國企業(yè)License-out重磅交易項目,涉及企業(yè)包括恒瑞醫(yī)藥、復宏漢霖、天境生物、豪森藥業(yè)等,合作大大促進了其國內發(fā)展。
隨著中國生物科技(biotech)的不斷崛起,國產新藥License-out模式已成大勢。越來越多的跨國制藥企業(yè)也開始與我國創(chuàng)新藥企業(yè)進行產品合作,中國Biotech的License-out模式風起云涌。從靶點確定到化學分子設計完全依靠自主創(chuàng)新,借助獨特的AI輔助研發(fā)平臺和產業(yè)生態(tài)資源,未來我國醫(yī)藥快速向生物醫(yī)藥(Bio‐pharma)發(fā)展,以不斷提升的硬核創(chuàng)新新藥研發(fā)能力服務更多全球患者。國內16家創(chuàng)新企業(yè)授權產品包括新藥研發(fā)的前沿領域熱門療法,如CAR-T,ADC,BTK,EGFR-TKI,PD-1等新藥走出了堅定的國際合作之路。
2021年,我國在License-in模式與License-out模式的權衡方面獲得了不少經驗。License-in是促進國際商業(yè)合作的模式,其關注點包括:1)頭腦需要清晰,由于前端臨床前研究缺失,導致引進公司自主開發(fā)能力或者藥物發(fā)現能力不被市場認可;2)權益需要明確,可能會喪失向外授權全球市場的權益;3)內卷發(fā)展機遇需要把握,引進管線后的工作主要聚焦于臨床開發(fā)和商業(yè)化推廣的內卷式發(fā)展;4)商業(yè)能力需要提高,臨 床 開 發(fā) 可 以 交 給 醫(yī) 藥 研 發(fā) 合 同 外 包 服 務 機 構(CRO),而所引入Biotech的商業(yè)化能力一般都是缺失的,因此短期內拓展市場有難度。License-out是創(chuàng)新走出國門的模式,其關注點包括:1)能否取得原創(chuàng)認可,由于其原創(chuàng)性可更好地被國際認可,與跨國大制藥企業(yè)的合作更加受到關注;2)有無外在優(yōu)勢,利用外在優(yōu)勢完善其臨床前的不足,特別是機制和前景分析;3)是否具有臨床優(yōu)勢,有利于利用多中心臨床試驗資源,爭取時間探索市場的可能性;4)能否共享雙贏,合作有利于促進國內發(fā)展。
2.4 監(jiān)管科學新理念推出三大發(fā)展紅利,創(chuàng)新發(fā)展獲支持
監(jiān)管科學新理念,推出了三大發(fā)展紅利。一是國家鼓勵創(chuàng)新和監(jiān)管科學提升。2021年醫(yī)藥行業(yè)政策密集出臺。國家層面發(fā)布醫(yī)療和醫(yī)藥行業(yè)相關政策共計500余條,其中醫(yī)藥政策數量約占60%。這有賴于創(chuàng)新政策推動下的“十一五”至“十三五”規(guī)劃,以及重大專項推進夯實的基礎。二是創(chuàng)新藥企業(yè)專注研發(fā)創(chuàng)新,仿制藥企業(yè)專注提高質量、降低成本,做大市場規(guī)模。2021年,醫(yī)藥上市公司研發(fā)費用持續(xù)加碼,創(chuàng)新轉型趨勢延續(xù)。三是發(fā)展模式積極創(chuàng)新。無論是跟隨仿制還是跟隨創(chuàng)新、原始創(chuàng)新,以及License-in和License-out合作模式促進發(fā)展,合作盈利初見成效,防范創(chuàng)新賽道上的阻塞和內耗、把握企業(yè)仿與創(chuàng)位置的能力逐漸提高。2018年以來,圍繞創(chuàng)新“燒錢”與投資的關系,科學家-企業(yè)家-投資家(三家)的對話機制,以及投資風險評估正逐步完善。
從監(jiān)管科學的角度來認識,近年來,國家機構改革持續(xù)推進,醫(yī)藥監(jiān)管“九龍治水”的局面得到很大改觀,但涉藥的管理部門仍然不少,有國家衛(wèi)生健康委、中醫(yī)藥管理局、市場監(jiān)管總局、藥監(jiān)局、發(fā)改委、科技部、工信部、醫(yī)保局、環(huán)保部以及公安部、海關和軍隊單位等。因此,提高部門協(xié)調、政策聯動、形成監(jiān)管高效應,對于推進創(chuàng)新型國家建設和健康中國戰(zhàn)略性醫(yī)藥產業(yè)創(chuàng)新高質量發(fā)展至關重要。醫(yī)藥行業(yè)期待國家層面能夠建立和形成促進國家醫(yī)藥協(xié)調發(fā)展的工作機制,不僅有利于應對突發(fā)衛(wèi)生公共事件,也有利于醫(yī)藥產業(yè)的長期穩(wěn)定發(fā)展。
3 展望未來:創(chuàng)新發(fā)展和轉型發(fā)展面臨挑戰(zhàn)
3.1 在競爭中發(fā)展,創(chuàng)新未必都有未來
藥品與人類健康息息相關,各國政府對藥品從研發(fā)、上市、流通到使用的管理均有嚴格的法規(guī)要求。“藥品的生命周期”包括從藥品的研發(fā)開始,到注冊評價、上市使用、再評價,直至由于療效和安全性問題等原因撤市的整個過程,包括引入期-成長期-成熟期-衰退期(圖1)。不同藥品在此生命周期中的長短差異很大,現在已經很難看到有像阿司匹林、胰島素、青霉素那樣“高齡將軍”的藥品。因此,從某種意義上說,創(chuàng)新藥物未必都有未來。
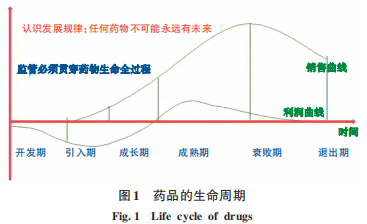
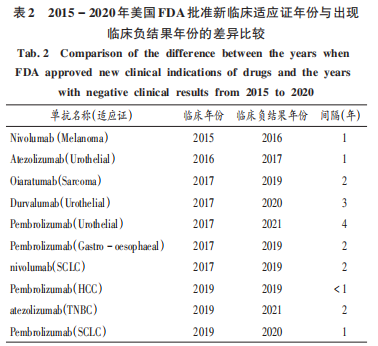
新藥研發(fā)由于研發(fā)長周期與高投入,其失敗的風險極高。近20年來,藥物研發(fā)創(chuàng)新的回報率越來越低, 由2000年的10%降到2020年的3. 1%。表2顯示了美國食品藥物管理局(FDA)2015年以來批準藥品新的臨床適應證開始和出現臨床負面結果的年份,可見其間隔年份的差異。因此,藥品研發(fā)企業(yè)如何把握相關尺度顯得尤為重要。
藥品的引入、成長、成熟、衰退的生命周期受多種因素影響,其退市的原因有藥物本身的優(yōu)勢特點、發(fā)展戰(zhàn)略、市場競爭等問題,更有臨床優(yōu)勢和安全性問題,如因出現療效更好或副作用更低的新產品而被自然淘汰。藥品的使用本身就是一個利益與風險平衡的選擇,特別是藥品在成長期的大規(guī)模臨床使用過程中出現標志性“臨床終點”不能實現,或不優(yōu)于現有療法的情況,就離淘汰不遠了。
由于醫(yī)藥行業(yè)自身的特點,如受到嚴格控制及管理的特點,針對以研發(fā)為基礎的制藥企業(yè)所推出的處方藥,在其生命周期不同階段的營銷戰(zhàn)略進行探討,也是企業(yè)發(fā)展需要考慮的問題。主要的考慮包括:因新產品在中國上市的滯后性,需要分析產品的優(yōu)勢、競爭特點以及內卷發(fā)展的可能性,調整臨床開發(fā)計劃;國內醫(yī)生的用藥習慣和患者的支付能力;產品專利到期對產品生命周期的影響;產品衰退期拐點的分析,對于把握好退出時機也很重要。
3.2 在創(chuàng)新賽道上的差異化發(fā)展
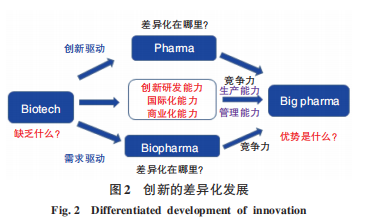
在生物醫(yī)藥研發(fā)產業(yè)鏈上,不同規(guī)模、不同階段、不同方向的協(xié)同發(fā)展和組合是獲得成功的基本要素。即使在發(fā)達國家,一個企業(yè)也不可能包羅萬象、涵蓋所有的方面,我們尤其應該強調創(chuàng)新的差異化發(fā)展(圖2)。筆者曾在2018年指出:未來生物醫(yī)藥發(fā)展必須重視產業(yè)轉型的問題,“大型藥企”的概念將不復“存在”;醫(yī)藥企業(yè)收入將不再僅僅依賴藥品“銷售”;隨著國際合作趨勢加強,應對行業(yè)的“合規(guī)”問題必須加以重視。因此,某方面的發(fā)展可能會從零開始,建立起一個全新的產業(yè)系統(tǒng);面對發(fā)展機遇,不同類別的企業(yè)能否進行緊密合作,也是成功的戰(zhàn)略思維需要考慮的問題。
3.3 創(chuàng)新思維與能力影響創(chuàng)新轉化
發(fā)展生物醫(yī)藥,需要基礎創(chuàng)新、技術創(chuàng)新,而科學、技術、專利人才都是有國界的。認識基礎研究的“卡腦子”問題,認識技術上的“卡脖子”問題,解決“雙卡”,需要健康的研發(fā)生態(tài)環(huán)境(圖3)。
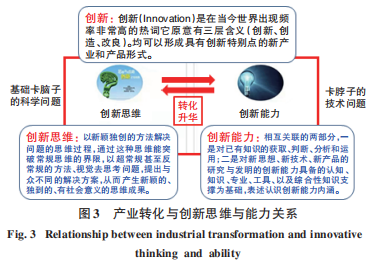
創(chuàng)新驅動下的科學技術問題,需要自主自強地處理好原始創(chuàng)新的“卡腦子”的科學問題和“卡脖子”的技術問題。Science公布的125個科學問題,11個醫(yī)學與健康問題中有5個與傳染病防治有關,包括流行病預測、病毒性感染、疫苗研發(fā)、創(chuàng)新藥設計以及抗生素耐藥等。“十四五”計劃中重點生物醫(yī)藥研發(fā)的科學和工程技術問題提出的10個問題中,有一半是與傳染病等重大疾病防治有關的前沿科學和前沿技術問題。面對國家生物醫(yī)藥發(fā)展重點,優(yōu)勢基礎-產業(yè)-人才在哪里?選擇突破在哪里?需要研發(fā)者“自立-自強-自信”,一切都是買不來、要不來、討不來的。具有基礎研究能力的專業(yè)研究院所必須關注國家發(fā)展和社會發(fā)展的迫切需求,在國家投入下潛心、靜心、精心研究,而不圖急功近利,努力提高成果的轉化和產業(yè)化。發(fā)達國家對中國的封鎖是必然的!
科學規(guī)律也提供了藥物創(chuàng)新需要謹慎的理由。在有更多的時間觀察臨床試驗中的志愿者之前,我們無法確定一種療法的長期安全性。藥物在生產和上市過程中,如果違背科學規(guī)律,就可能面臨失敗。
3.4 以需求為導向的生物醫(yī)藥發(fā)展面臨的挑戰(zhàn)
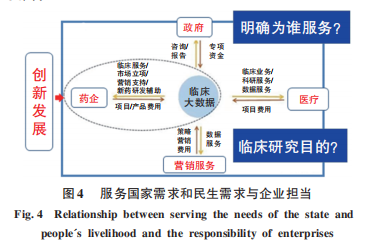
3.4.1 從服務國家需求和民生需求看挑戰(zhàn)
公共衛(wèi)生的民生需求戰(zhàn)略的變化是轉型發(fā)展的出發(fā)點,從長遠看需考慮促進防‐醫(yī)‐保產品長效管理機制,把握生物醫(yī)藥由疾病經濟向健康經濟轉型的機遇和挑戰(zhàn)。在新的歷史時期,堅信創(chuàng)新、協(xié)調、綠色、開放、共享的健康發(fā)展理念,創(chuàng)新作為社會經濟發(fā)展的重大戰(zhàn)略,將大大促進促進科技成果轉化,推動醫(yī)藥向高質量發(fā)展。中國生物醫(yī)藥創(chuàng)新是全球創(chuàng)新的重要組成部分,當今世界的深刻變化既帶來新挑戰(zhàn),也帶來新機遇。
在認識服務國家需求和民生需求與企業(yè)擔當(圖4)這一問題時,面對當前世界形勢百年未有之大變局,我國醫(yī)藥產業(yè)要提升核心競爭力,走自主自強的發(fā)展道路,不斷加強對基礎理論、基礎材料的研究,努力實現對先進制造和先進工藝的研究突破。面對產業(yè)發(fā)展中遇到的科學技術問題,要克服大而全的發(fā)展傾向,建立全新的、緊密的醫(yī)藥產業(yè)研發(fā)系統(tǒng),多措并舉解決發(fā)展問題,如將非核心研發(fā)業(yè)務外包給專業(yè)機構、建立非競爭性的研發(fā)聯盟等;要建立科學的研發(fā)思維,將“誰來做(who)、做什么(what)、在哪里做(where)、什么時候做(when)、為什么做(why)、結果如何(how)”這6個關鍵維度應用到藥物研發(fā)中,助力藥物研發(fā)效率的提高。
洞見未來,就是不忘本來,吸收外來,面向未來。中國醫(yī)藥政策導向從過去直接鼓勵產品創(chuàng)新,逐步升級到關注臨床價值和臨床需求,這無疑進一步延伸和豐富了產業(yè)創(chuàng)新的價值內涵。中國的自強,加快了跨國制藥企業(yè)擁抱中國本土創(chuàng)新創(chuàng)業(yè)的速度:從研發(fā)中心到創(chuàng)新中心的變化,從被動技術轉移到主動技術合作,中國產業(yè)環(huán)境巨變“in china.for china”更推動了中國本土創(chuàng)新環(huán)境和臨床需求發(fā)展,使其贏得了中國龐大的創(chuàng)新醫(yī)藥市場。
3.4.2 從創(chuàng)新差異化發(fā)展看挑戰(zhàn)
從創(chuàng)新差異化發(fā)展方面看挑戰(zhàn),一是應該看到上市的“me too”新藥產品在國內成功商業(yè)化的概率不高;二是國內“me too”新藥的“類仿制藥競爭態(tài)勢”,才是每個制藥企業(yè)和投資人需要重點考慮的風險;三是研發(fā)投入明顯不足,國內“me too”新藥的開發(fā)成本不到1億美元,從新藥臨床試驗申請(IND)到取得新藥批件的成功概率高達80%,而歐美“first in class”新藥開發(fā)成本平均10~26億美元,從進入臨床試驗到取得新藥批件的成功率低于10%;四是我國幾乎都不做“頭對頭”臨床試驗,沒有確切數據證明自己的產品更好,價格是唯一最客觀的指標;五是我國國際多中心臨床試驗結果少,內卷式(China only型)研究多,很難進入國際市場。
3.4.3 從Lisence‐in到Lisence‐out模式轉變看挑戰(zhàn)
License‐in是一種產品引入方式,其核心是“產品引進方”向“產品授權方”支付一定的首付款,雙方約定一定金額的里程碑費用(按品種開發(fā)進展)和未來的銷售提成,從而獲得產品在某些國家(地區(qū))的研發(fā)、生產和銷售的商業(yè)化權利。該模式有別于傳統(tǒng)的以醫(yī)藥公司自己研究新藥或收購創(chuàng)新藥公司為主的兩種投資方式。License‐in模式不是一種好的商業(yè)模式。
與License‐in模式不同,License‐out模式一向被認為是創(chuàng)新走出國門,具有諸多優(yōu)勢,有利于利用外在優(yōu)勢,促進國內發(fā)展。一個制藥企業(yè)靠License‐in模式是長不大的,因為原創(chuàng)引不來、買不來、要不來!國外企業(yè)是因為看到中國“人多病多”的大市場才愿意合作的。Lisence‐in模式可縮短研發(fā)時間、提高研發(fā)效率、減少固定投入,通過資金實現研發(fā)的“彎道超車”并造就了“再鼎”等知名上市公司。但2021年Lisence‐in占比過大的制藥企業(yè)首次公開募股(IPO)多已被否,而Lisence‐out取而代之且大為火爆,交易金額屢創(chuàng)新高。Lisence‐out模式標志著我國科學家的生物醫(yī)藥科研成果被國際同行認可,是企業(yè)醫(yī)藥創(chuàng)新能力的體現。
2017年10月8日,中共中央辦公廳、國務院辦公廳發(fā)布《關于深化審評審批制度改革鼓勵藥品醫(yī)療器械創(chuàng)新的意見》(廳字〔2017〕42號),開啟了中國創(chuàng)新藥的發(fā)展大潮。2021年7月2日CDE發(fā)布《以臨床價值為導向的抗腫瘤藥物臨床研發(fā)指導原則(征求意見稿)》,則正式宣告中國創(chuàng)新藥“套利時代”的結束,引發(fā)醫(yī)藥股股價大跌,也引發(fā)了行業(yè)對“me too”、創(chuàng)新成色和內卷的大討論。長期以來,IPO首日股價大漲在大家心目中已是“必然”,并造就了專業(yè)打新(買新發(fā)行的股票)的“獲利一族”,而2021年醫(yī)藥新股則頻頻破發(fā),更不幸的是IPO失敗。自2019年7月科創(chuàng)板開市以來,截至2021年12月,共有77家醫(yī)藥生物企業(yè)擬登陸科創(chuàng)板,僅2021年就有34家,其中13家IPO審核終止,近80%為主動撤回申請。
IDEA Pharma醫(yī)藥咨詢公司以藥物發(fā)明指數(phar‐maceutical invention indices,PIVI)和藥物創(chuàng)新指數(pharmaceutical innovation indices,PINI)兩個指標對全球主要制藥企業(yè)創(chuàng)新力進行排名并發(fā)布榜單。在IDEA Pharma看來,發(fā)明(invention)是以新穎的方式將想法和技術結合起來,去創(chuàng)造此前不存在的事物;而創(chuàng)新(in‐novation)則是發(fā)明的回報,利用發(fā)明去創(chuàng)造有意義的價值。
3.4.4 從內卷‐商業(yè)化看Biotech短板
研發(fā)的終極目標是給患者提供更好的醫(yī)藥產品,因此,科技含量再高的研發(fā)成果也必須使其產品上市銷售最大化,才能實現研發(fā)投入的最高回報。作為首批商業(yè)化(上市銷售)的本土制藥企業(yè)自研創(chuàng)新藥PD‐1,其上市銷售遠遜于預期,首批上市并已納入醫(yī)療保險的達伯舒、艾瑞卡、百澤安、拓益等4款國產PD‐1,2021年前3季度銷售額也就80多億元(恒瑞因未披露,暫以其去年銷售額的3/4計)。如果創(chuàng)新策略仍然是“快速跟隨”,而非原始創(chuàng)新,是不可能沒有研發(fā)出一種真正具有全球市場競爭力的“first in class”重磅藥物,因此而期待形成具有巨大市值和世界市場也是很困難的。
4 結語
回首百年,歷經艱難奮斗,我國醫(yī)藥創(chuàng)新能力已大大提高。盤點 2021 年,我國生物醫(yī)藥發(fā)展成績斐然。國家鼓勵創(chuàng)新和監(jiān)管科學提升、創(chuàng)新藥企業(yè)專注研發(fā)創(chuàng)新與仿制藥企業(yè)專注質提高量、發(fā)展模式創(chuàng)新這三大發(fā)展紅利有力支撐了醫(yī)藥創(chuàng)新發(fā)展。
在新政環(huán)境下,洞見未來醫(yī)藥發(fā)展趨勢:(1)隨著市場信息透明化提升,熱門藥物被高度關注;(2)大數據引導新藥研發(fā)成本逐漸降低,導致研發(fā)競爭;(3)新藥市場獨占期縮短,面臨著同類新藥和仿制藥的激烈競爭;(4)斷定新藥開發(fā)風險加劇,投資回報可期更難。從發(fā)現到新藥批準是一個漫長的過程,成本巨大、風險極高。
為積極有效應對世界醫(yī)藥創(chuàng)新競爭帶來的挑戰(zhàn),我國醫(yī)藥行業(yè)(包括產業(yè)、商業(yè)、醫(yī)療、投資的整合)必須為可持續(xù)發(fā)展做好頂層設計,構建可持續(xù)的創(chuàng)新生態(tài)環(huán)境,促進和提升創(chuàng)新主體活力,認清我國制藥企業(yè)發(fā)展的短板,定位好我國創(chuàng)新藥領域的目標,才能為我國醫(yī)藥產業(yè)進入全球產業(yè)鏈從而提高全球市場份額提供保障。
我國生物醫(yī)藥創(chuàng)新發(fā)展,迫切需要加強并完善夯實強國基礎、守正創(chuàng)新、完善產業(yè)體系、做大國際貿易和實行雙循環(huán)促進內需等方面的舉措,以積極防范和化解世界格局百年未有之大變局給我國醫(yī)藥經濟發(fā)展、人民衛(wèi)生健康事業(yè)建設帶來的沖擊和風險。
參考文獻:略。
該文完整發(fā)布于《中國藥業(yè)》雜志2022年2月20日出版的第31卷第4期第1~7頁。
掃描下方二維碼即可查看當期雜志全部內容↓↓↓
