重慶市新型冠狀病毒肺炎疫情期間臨床試驗開展現狀調查
Investigation on the Current Situation of Clinical Trial During COVID - 19 Epidemic in Chongqing
霍本念1 ,李晨2 ,賈運濤 1 ,宋林1 ,李斌2 ,徐靖2 ,向明鳳 2 ,宋鴻宇 2 ,艾茂林 1 ,尹楠戈 1 ,劉耀2△
(1.重慶醫科大學附屬兒童醫院藥學部·國家兒童健康與疾病臨床醫學研究中心·兒童發育疾病研究教育部重點實驗室·兒科學重慶市重點實驗室;2.中國人民解放軍陸軍特色醫學中心藥劑科)
* 基金項目:重慶市科技計劃項目[cstc2020jsyj - zzysbAX0024]
摘 要
目的:為完善藥物臨床試驗機構(以下簡稱機構)質量管理體系建設提供參考。方法:采用橫斷面研究設計,以半結構訪談法制訂重大疫情暴發期間臨床試驗項目的現狀調查問卷表;通過問卷星軟件制作問卷,于2021年1月15日至1月31日在重慶市范圍內采用方便抽樣聯合滾雪球抽樣的混合抽樣方式進行調查,通過微信、QQ、電子郵件等方式向調查對象發放電子問卷二維碼。分析重慶市新型冠狀病毒肺炎疫情暴發期間和復工期間臨床試驗項目開展情況,并分析相關影響因素。結果:回收282份有效問卷,有效回收率為100.00%,其中89.01%(251/282)的調查對象具有參與臨床試驗項目的經驗。與復工期間比較,疫情暴發期間的項目立項(χ2=237.37,P<0.001)、倫理審查的速度(χ2=211.53,P<0.001)、項目合同簽署(χ2=129.38,P<0.001)、人遺傳辦申報(χ2=125.95,P<0.001)、新項目啟動(χ2=276.37,P<0.001)、項目質量(χ2=159.53,P<0.001)均受到較大影響。新項目立項受阻的原因主要為機構建議暫緩或不接待,嚴重不良事件或方案違背不能及時上報的原因主要為研究醫師無法及時獲知受試者信息,項目質量受影響的原因主要為訪視計劃被打亂。結論:各機構應梳理與總結疫情期間各方面的處置措施,引入信息化手段保障質量,推進臨床試驗信息共享,降低突發公共衛生事件對臨床試驗的影響。
關鍵詞:新型冠狀病毒肺炎疫情;突發公共衛生事件;臨床試驗;現狀調查
Key words: coronavirus disease 2019 epidemic;public health emergencies;clinical trial;investigation on the current situation
中圖分類號:R95 文獻標志碼:A
臨床試驗是驗證藥物在人體內的安全性和有效性的唯一方法,受試者的權益和安全是首要考慮因素,只有當預期的獲益大于風險時,方可實施或繼續臨床試驗。重大公共衛生事件對臨床試驗的實施提出了嚴峻考驗,很多臨床試驗都面臨諸多新問題和實際困難。臨床研究協調員(CRC)不能到院工作和臨床研究監查員(CRA)監查時受到限制,如何保障項目質量,受試者能否按時隨訪,保障受試者連續用藥和受試者依從性,如何收集臨床試驗數據確保試驗可溯源,以及多中心臨床試驗如何實現信息共享等。因此,做好疫情暴發期間臨床試驗的管理工作是臨床試驗相關方管理者應重點考慮的問題。本研究中調查了重慶市各藥物臨床試驗機構(簡稱機構)在疫情暴發期間和復工期間臨床試驗項目的開展情況,并分析相關影響因素,為機構應對突發公共衛生事件制訂安全監管措施和完善質量管理體系建設提供參考,保障受試者安全和試驗項目質量,減少未來突發公共衛生事件對臨床試驗的影響。現報道如下。
1 對象與方法
1.1 調查對象
在重慶市各機構辦公且與臨床試驗相關的人員,包括機構人員、倫理人員、研究醫師、研究護士、CRA、CRC、稽查員及其他。
1.2 問卷設計
對機構秘書、倫理委員會秘書、研究醫師、研究護士、CRA和CRC進行半結構訪談,制訂重大疫情暴發期間臨床試驗項目的現狀調查問卷表。
調查問卷表的內容包括以下5個方面。1)基本信息:包括調查對象擔任的角色和負責項目的數量。2)疫情暴發期間與復工期間機構的運行情況:包括來訪人員來院要求、機構現場辦公開放情況、召開倫理會的頻次和方式、機構新項目召開啟動培訓會的方式,項目可否篩選新患者入組及已入組患者能否正常訪視。3)疫情暴發期間與復工期間臨床試驗啟動前各流程受影響的情況:包括項目立項、倫理審查的速度、項目合同簽署、人遺傳辦申報、新項目啟動是否受阻或減慢。4)調查疫情暴發期間與復工期間臨床試驗受阻的原因:一般情況下,新項目立項是臨床試驗啟動前的第一環節和必經程序;試驗進行中受試者發生的嚴重不良事件(SAE)或發生的方案違背得到及時上報是保障受試者安全和權益的重要措施。分別選擇新項目立項受阻及對SAE或方案違背不能及時上報的原因進行調查。5)疫情暴發期間與復工期間臨床試驗項目研究質量的對比情況:包括臨床試驗質量受影響因素的分布和項目研究質量受影響的分級情況。
項目質量的研究評估包括受試者知情同意、受試者合格性(符合納入、排除標準)、合并用藥(伴隨用藥)、療效/有效性指標、研究藥物管理、實驗室評估、隨機標準、法規或倫理、SAE、原始文件、研究程序、訪視計劃、文件記錄和其他。試驗質量受到的影響分為輕微影響、個別影響、嚴重影響、極嚴重影響、不受影響。其中,輕微影響是指項目質量受到1~2個方面的影響,但無方案偏離或未發生與藥品相關的不良事件(AE)或SAE;個別影響是指項目質量受到少于3個方面的影響,僅個別受試者有輕微的方案偏離,但未發生與藥品相關的AE或SAE;嚴重影響是指項目質量受到少于5個方面的影響,發生方案偏離的數量少于總人數的2%或發生與藥品相關的AE(<總人數的2%)或SAE(1例);極嚴重影響是指項目質量受到不少于5個方面的影響,發生嚴重的方案偏離的數量超過3%或與藥品相關的AE(>總人數3%)或SAE(2例以上);不受影響是指項目質量未受到影響。
1.3 調查方法
采用橫斷面研究設計,通過問卷星軟件制作調查問卷,在重慶市范圍內采用方便抽樣聯合滾雪球抽樣的混合抽樣方式選取調查對象進行問卷調查。方便抽樣是指根據調查者的方便隨機選取符合調查對象的樣本,以無目標、隨意的方式進行抽樣;滾雪球抽樣是指先隨機選擇部分調查對象進行調查,給接受調查的人員說明調查目的和可以參與本次調查的對象,并轉發給符合調查對象的其他人員的累積過程。
于2021年1月15日至1月31日,通過微信、QQ、電子郵件等方式向調查對象發放電子問卷二維碼。預調查200份問卷,實際發放282份,評估調查對象是否理解問卷的內容,遵循自愿參與和匿名原則,并請接受調查的人員將問卷二維碼發給身邊符合調查對象的其他人員。每個手機IP只能完成1次調查,避免重復調查,以保證數據真實可靠。
1.4 統計學處理
采用SPSS22.0統計學軟件分析。計數資料以率(%)表示,行χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 一般資料
共回收282份有效問卷,有效回收率為100.00%。其中,89.01%(251/282)的調查對象具有參與臨床試驗項目的經驗。調查對象一般資料見表1。
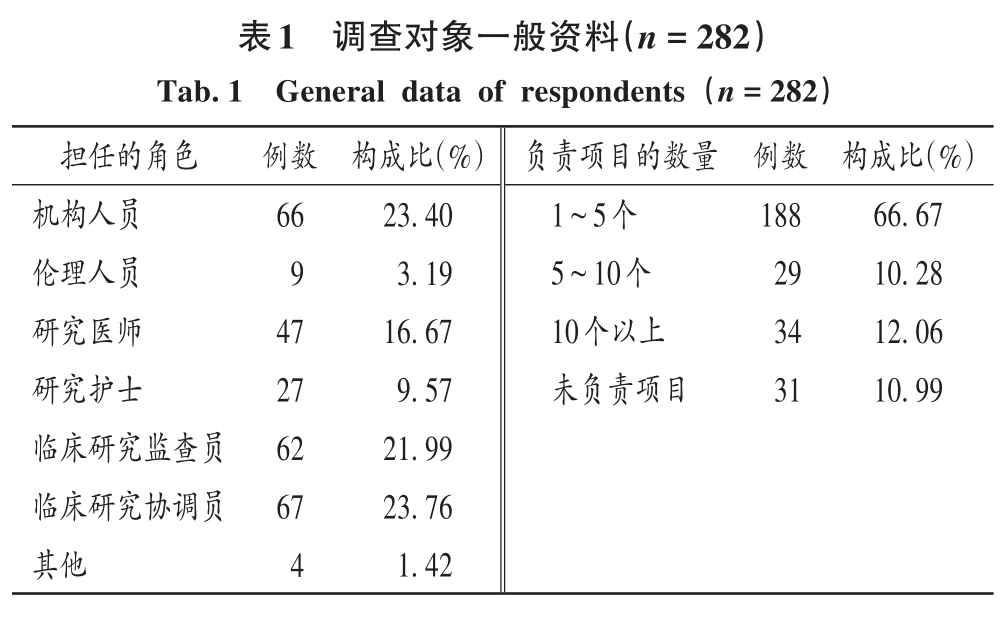
2.2 機構運行情況
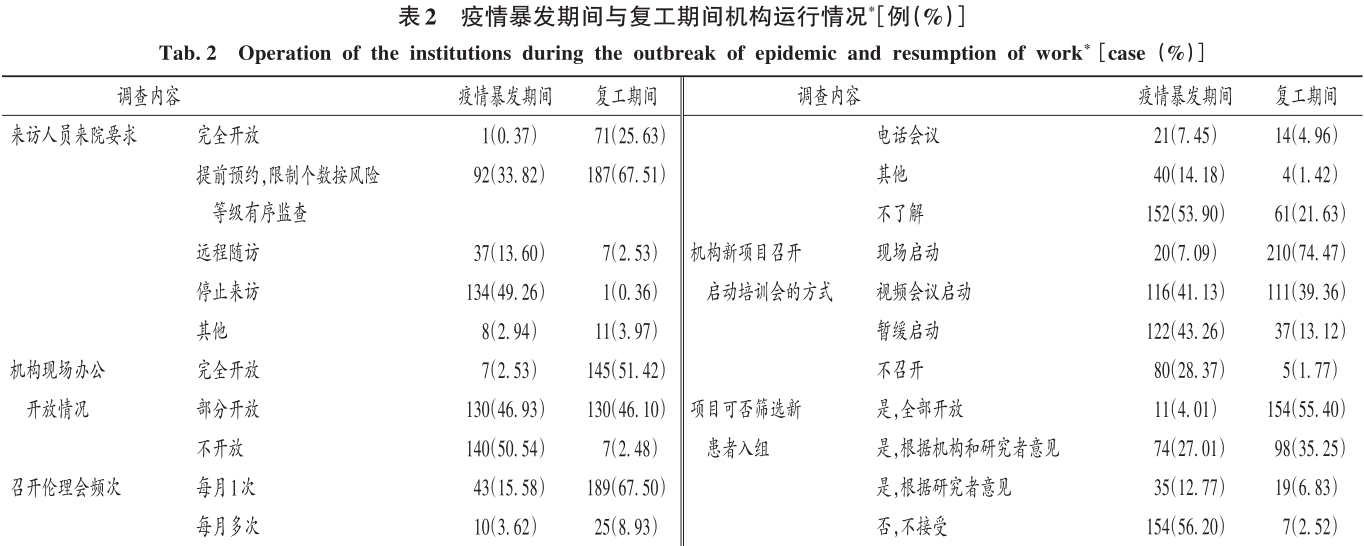
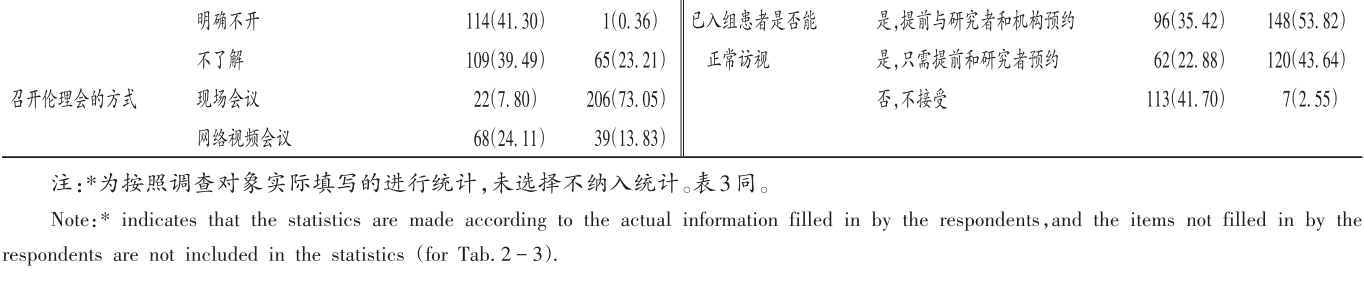
疫情暴發期間與復工期間機構運行情況見表2。
2.3 臨床試驗各環節實施情況
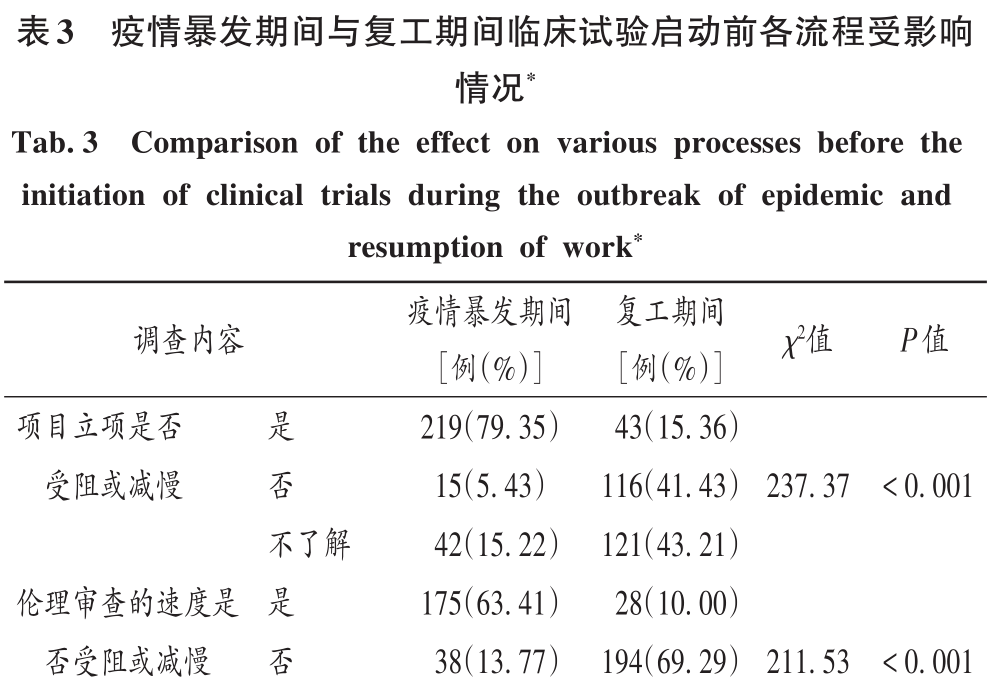
疫情暴發期間與復工期間臨床試驗啟動前各流程受影響情況見表3。
2.4 臨床試驗受阻原因
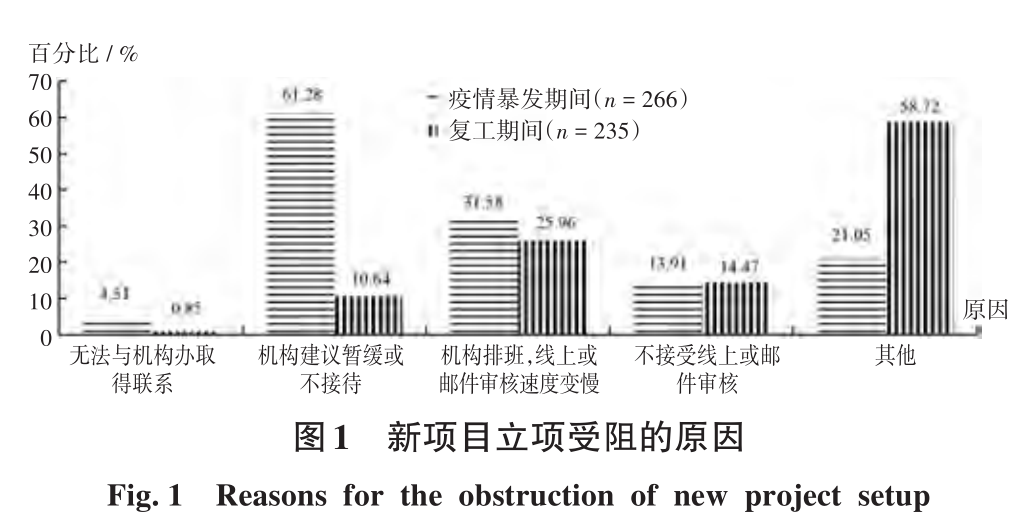
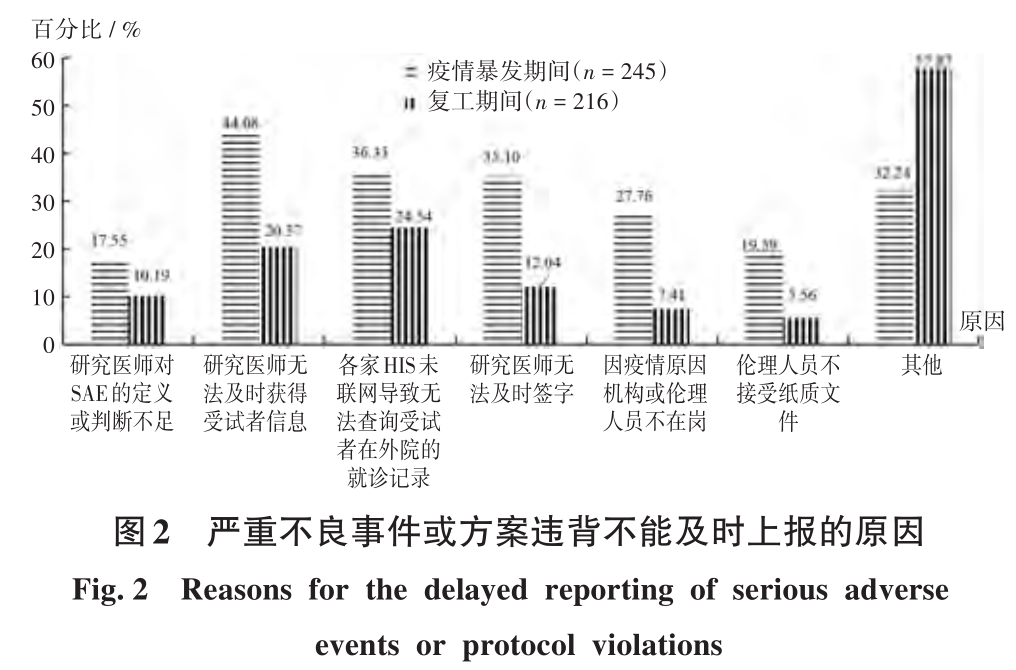
疫情暴發期間新項目立項受阻的主要原因為機構建議暫緩或不接待(61.28%);復工期間新項目立項受阻的主要原因為機構排班,線上或郵件審核速度變慢(25.96%),詳見圖1。疫情暴發期間和復工期間SAE或方案違背上報受阻的主要原因為研究醫師無法及時獲得受試者信息及各家醫院信息系統(HIS)未聯網導致無法查詢受試者外院就診記錄,詳見圖2。
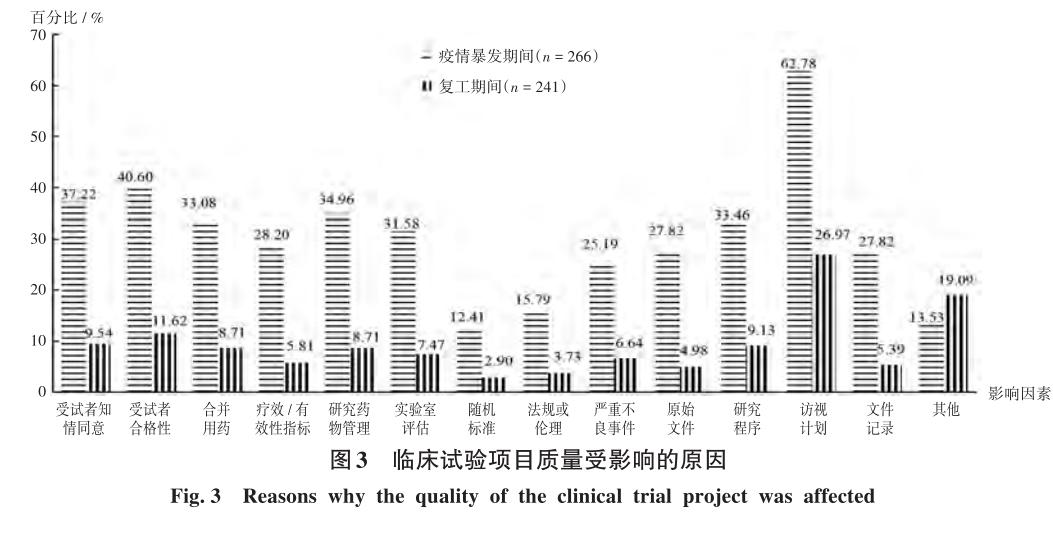
2.5 臨床試驗項目研究質量
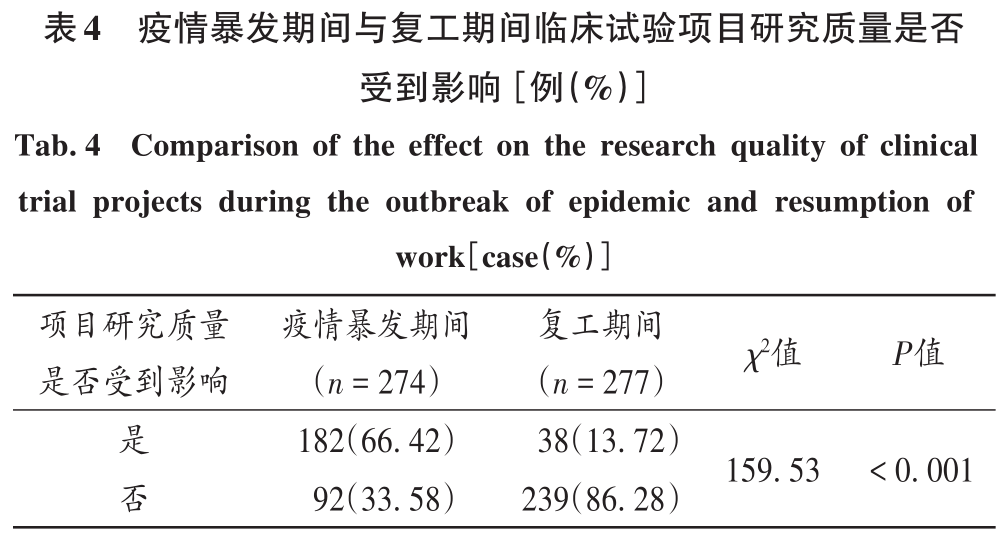
疫情暴發期間,臨床試驗項目質量受到的影響較復工期間大(χ2=159.53,P<0.001),詳見表4。疫情暴發期間和復工期間項目質量受影響的因素較多,均主要表現為訪視計劃被打亂導致超窗,分別占62.78%和26.97%,詳見圖3。疫情暴發期間,共調查274名對象,27.57%認為試驗受輕微影響,27.94%認為試驗受個別影響,25.00%認為試驗受嚴重影響,4.41%認為試驗受影響極嚴重,15.81%認為試驗不受影響;復工期間,共調查277名對象,21.74%認為試驗受輕微影響,17.75%認為試驗受個別影響,1.45%認為試驗受影響嚴重,0.36%認為試驗受影響極嚴重,59.06%認為試驗不受影響。
2.6 臨床試驗數據共享
共調查278名對象,17.63%表示機構已建立受試者重復篩選的篩查系統,39.21%表示機構未建立,43.17%表示不了解。共調查277名對象,14.80%表示機構能與其他單位共享檢查數據,44.40%表示機構不可以共享,40.79%表示不了解。疫情暴發期間,共調查270名對象,67.04%表示機構接受在外院檢驗的數據,32.96%表示機構不接受;復工期間共調查273名對象,52.75%表示機構接受,47.25%表示機構不接受。
3 討論
由表3和表4可知,疫情的突然暴發使受試者的權益和申辦方的利益均受到較大影響,疫情暴發期間新項目立項、倫理審查的速度、合同簽署、人遺傳辦申報、新項目啟動受到的影響均較復工期間大,最終導致疫情期間臨床項目質量受到的影響較復工期間大。傳統臨床試驗面臨著許多實際困難,如無法現場遞交資料、倫理審查延遲或取消、受試者招募擱置、受試者難以定期訪視導致方案偏離等。對此,國家藥品監督管理局藥品審評中心建議,疫情暴發期間可嘗試選擇遠程智能臨床試驗方法,借助智能化臨床試驗管理平臺及遠程通信技術,以受試者為中心開展臨床試驗。本研究結果顯示,疫情暴發期間新項目立項受阻的原因主要為機構暫緩或不接待,可預見臨床試驗全流程的信息管理已成必然趨勢,既是新形勢下國家管理部門對于機構日益嚴格的監管要求,也是解決醫療機構在臨床試驗執行過程中的實際困難和預防潛在風險的必要基礎保障。本研究中調查對象和機構均在重慶市,但重慶市多數醫院獲批為藥物臨床試驗機構較晚,且承接項目的經驗有限,機構的信息化平臺建設相對較晚和滯后,疫情暴發期間暴露了臨床試驗工作開展的薄弱環節。本研究中,疫情暴發期間新項目立項受阻的原因主要為機構建議暫緩或不接待,復工期間新項目立項受阻的主要原因為機構排班,線上或郵件審核速度變慢。因此,機構應以此次疫情為契機,積極構建信息管理系統,建立線上審核系統,實現從紙質化審查到線上審查和從線下審查到線上審查的轉變,推進臨床試驗的進程和保證臨床試驗可溯源,從整體上提高藥物臨床研究的工作效率、研究質量及研究能力。
《藥物臨床試驗質量管理規范》(GCP)對于SAE的定義是受試者接受試驗用藥品后出現死亡、危及生命、永久或嚴重的殘疾或功能喪失、受試者需住院治療或延長住院時間,以及先天性異常或出生缺陷等不良醫學事件,且在臨床試驗過程中,記錄和上報受試者發生的SAE是研究者應盡的責任和義務。同時,GCP規定未經申辦者和倫理委員會同意,研究者不得修改或偏離試驗方案,發生了方案偏離時及時上報是研究者的基本職責,故本研究中重點選擇疫情暴發期間和復工期間SAE或方案違背上報受阻的原因進行分析。結果疫情暴發期間和復工期間SAE或方案違背上報受阻的原因主要為研究者無法及時獲得受試者信息及各家醫院的HIS未聯網,導致無法查詢受試者外院就診記錄。因此,為避免SAE上報不及時,研究者應根據臨床試驗方案制訂受試者回訪計劃,根據計劃定期聯系和關心受試者,及時了解受試者的情況,同時加強受試者的依從性教育,讓受試者從不主動告知情況到主動及時告知情況的轉變。
臨床試驗的質量與新藥是否能獲批上市及保障公眾的健康和安全息息相關。本研究結果顯示,疫情暴發期間,25.00%的調查對象認為試驗質量受影響嚴重。疫情暴發期間和復工期間項目質量受影響的因素較多,主要表現在訪視計劃被打亂導致超窗,受試者不能在方案規定的時間范圍內得到治療,這對于受試者的安全是不利的。因此,為避免因疫情影響而打亂受試者的訪視計劃,可允許研究者在保證受試者安全的條件下將現場訪視轉換為線上訪視和允許受試者到就近醫院進行檢驗檢查,并及時做好受試者的訪視管理和檢驗檢查資料的收集與記錄。同時,各機構和申辦者應根據疫情暴發期間出現的問題梳理和總結各關鍵環節的流程和存在的問題,完善臨床試驗質量管理體系的構建,如是否可以簡化立項流程或立項資料的遞交,機構和倫理線上審查的適宜條件,受試者遠程隨訪和跨中心隨訪的標準操作規程,試驗藥物直接運輸至受試者的標準操作規程,疫情暴發期間試驗數據的收集、記錄與保存,申辦方或CRA的遠程監查等,保障疫情暴發期間有條不紊地開展臨床試驗。
實現臨床試驗的信息共享是加速轉化臨床資源,推動臨床研究發展,達到“戰疫”“防疫”目的的關鍵。臨床試驗信息共享一直是全世界致力于提高臨床試驗透明度的重要舉措,包括共享受試者的原始數據、總結性數據(如分析后的數據集、總結性成果、出版物等),以及試驗設計、注冊、實施等環節信息。在面對疫情暴發等突發公共衛生事件時,及時共享信息更重要,可為防控疫情、診治患者、評估發展趨勢和干預措施效果提供實時指導。同時,信息共享增加了臨床試驗的透明度,有助于提高臨床試驗的質量、試驗過程的規范性和試驗結果的可信度,為疫情的防控提供有效數據。參與調查的機構中僅14.80%的機構可以與其他單位共享檢查數據,可見臨床試驗信息共享機制亟待推進。
疫情等突發公共衛生事件對臨床試驗造成了重大影響,但同時也促進了臨床試驗的進一步發展,各機構應以疫情等重大公共衛生事件暴發為契機,充分總結與梳理疫情暴發期間各方面的處置措施,完善臨床試驗應急機制,建立相應的標準操作規程,引入信息化手段,以加強質量保障和工作效率,推進臨床試驗信息共享,建立具有針對性的臨床試驗人員培訓體系,培養專業化和規范化的臨床試驗研究人員,加強臨床試驗的機構建設,推動專業團隊建設,以降低未來疫情對臨床試驗的影響。
參考文獻:略。
作者簡介:
第一作者:霍本念,女,碩士研究生,主管藥師,研究方向為臨床試驗項目管理。
△ 通信作者:劉耀,博士,副主任藥師,研究方向為藥物臨床試驗管理、藥源性疾病。
該文完整發布于《中國藥業》雜志2022年6月5日出版的第31卷第11期第6~10頁。
掃描下方二維碼即可查看當期雜志內容↓↓↓
